题目内容
某化学研究性学习小组在学习了“空气中氧气含量测定”实验的基础上,改进了教材中的实验,设计出如图所示的实验装置.
实验步骤如下:
①如右图所示连接仪器,检查装置的气密性良好.
②在集气瓶里装入适量a体积的水,燃烧匙里放一块白磷,在酒精灯上把玻璃棒下端加热后,立刻将集气瓶上的三孔胶塞塞紧.
③迅速将预热过的玻璃棒按下与白磷接触.观察到白磷燃烧,产生大量白烟.
④待白磷燃烧完毕,将集气瓶稍加振荡,白烟消失.
⑤待集气瓶完全冷却至室温,打开止水夹,量出集气瓶中水的体积为b,整个集气瓶的体积为c.
⑥根据a、b、c三个数据,计算出空气中氧气的体积分数.
根据以上实验信息,回答下列有关问题:
(1)为了充分消耗容器中的氧气,药品中白磷的用量应保证______.
(2)若实验非常成功,请写出a、b、c三个数据应满足的一个等式关系______.
(3)小组成员小张对“实验前向集气瓶内装入适量a体积的水”不理解.咨询组长小明后,他终于明白加入水的作用,其一是______;其二是______.
(4)小组成员小红无意间发现,向b体积水中滴加几滴石蕊溶液,溶液会变成红色.请你对“变红”现象的原因提出大胆地猜想______.
【答案】分析:(1)要充分消耗掉氧气白磷的用量应该足量.
(2)利用氧气的量约占空气体积的五分之一解决问题.
(3)围绕“降温以及吸收燃烧产物”这一因素进行分析;
(4)从使石蕊试液变红色的溶液显酸性的知识进行猜想.
解答:解:(1)氧气是由于白磷燃烧而消耗的,所以要想使氧气消耗的更充分一些,需要加入过量的白磷.
故答案为:过量(或足量)
(2)由于氧气约占空气体积的五分之一,进入的水也是这一比例,则有b-a=(c-a)× ,化简得:c+4a=5b
,化简得:c+4a=5b
故答案为:c+4a=5b
(3)由于温度的改变会影响水的进入,所以需要使集气瓶温度尽快降低至室温,同时水也对吸收产物有一定作用.
故答案为:加快集气瓶的冷却;吸收(或溶解)白磷燃烧生成的五氧化二磷.
(4)酸性溶液能使石蕊试液变红,所以可从这一角度分析问题.
故答案为:白磷燃烧生成的五氧化二磷溶于水显酸性(或五氧化磷与水反应生成酸等合理答案)
点评:空气中氧气含量的测定也是中考考查的一个热点,重点考查实验过程中看到的现象以及导致实验结果偏大或偏小的原因.
(2)利用氧气的量约占空气体积的五分之一解决问题.
(3)围绕“降温以及吸收燃烧产物”这一因素进行分析;
(4)从使石蕊试液变红色的溶液显酸性的知识进行猜想.
解答:解:(1)氧气是由于白磷燃烧而消耗的,所以要想使氧气消耗的更充分一些,需要加入过量的白磷.
故答案为:过量(或足量)
(2)由于氧气约占空气体积的五分之一,进入的水也是这一比例,则有b-a=(c-a)×
 ,化简得:c+4a=5b
,化简得:c+4a=5b故答案为:c+4a=5b
(3)由于温度的改变会影响水的进入,所以需要使集气瓶温度尽快降低至室温,同时水也对吸收产物有一定作用.
故答案为:加快集气瓶的冷却;吸收(或溶解)白磷燃烧生成的五氧化二磷.
(4)酸性溶液能使石蕊试液变红,所以可从这一角度分析问题.
故答案为:白磷燃烧生成的五氧化二磷溶于水显酸性(或五氧化磷与水反应生成酸等合理答案)
点评:空气中氧气含量的测定也是中考考查的一个热点,重点考查实验过程中看到的现象以及导致实验结果偏大或偏小的原因.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
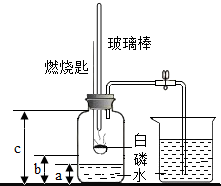 某化学研究性学习小组在学习了“空气中氧气含量测定”实验的基础上,改进了教材中的实验,设计出如图所示的实验装置.
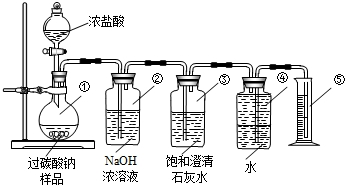
某化学研究性学习小组在学习了“空气中氧气含量测定”实验的基础上,改进了教材中的实验,设计出如图所示的实验装置.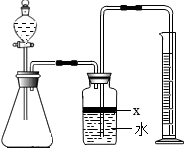 氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,某化学研究性学习小组设计并完成了如下实验.
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,某化学研究性学习小组设计并完成了如下实验.