题目内容
分类和对比是学习化学的重要方法。
(1)镁、铝、铁都属于活泼金属,在氧气中均能燃烧生成相应的氧化物。铁在氧气中燃烧的化学方程式为________;铝在氧气中燃烧的产物是________(写化学式)。
(2)碱是一类主要由金属元素和氢氧根组成的化合物,下列物质中,属于碱的是________(填字母序号)。
(3)通过下面甲和乙两个对比实验,分别得出的结论是:甲________;乙________。
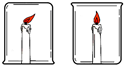
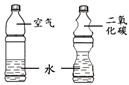
甲 乙
(4)碳酸钾和碳酸钙同属于碳酸盐,碳酸盐与盐酸反应的原理均相似,则碳酸钾与盐酸反应的化学方程式为________。
(1)镁、铝、铁都属于活泼金属,在氧气中均能燃烧生成相应的氧化物。铁在氧气中燃烧的化学方程式为________;铝在氧气中燃烧的产物是________(写化学式)。
(2)碱是一类主要由金属元素和氢氧根组成的化合物,下列物质中,属于碱的是________(填字母序号)。
| A.NaOH | B.H2O2 | C.FeSO4 | D.CaCO3 |


甲 乙
(4)碳酸钾和碳酸钙同属于碳酸盐,碳酸盐与盐酸反应的原理均相似,则碳酸钾与盐酸反应的化学方程式为________。
1)3Fe + 2O2 点燃 Fe3O4 Al2O3 (2)A
(3)甲:隔绝氧气(或空气)能灭火 乙:二氧化碳能溶于水
(4)K2CO3 + 2HCl 2KCl + H2O + CO2↑
(3)甲:隔绝氧气(或空气)能灭火 乙:二氧化碳能溶于水
(4)K2CO3 + 2HCl 2KCl + H2O + CO2↑
(1)铁丝在氧气中燃烧会生成四氧化三铁,铝在氧气中燃烧会生成氧化铝,依据反应物生成物及条件书写有关的方程式及化学式.
(2)在四个选项中只有氢氧化钠是由金属离子与氢氧根形成的化合物,因此它是碱,其它均不符合碱类特征.
(3)甲实验中烧杯的放与倒放其变化是对空气的隔绝与否,正放时氧气充足,倒放时氧气缺乏,从而使蜡烛燃烧或熄灭,所以结论是隔绝氧气能灭火;而乙实验则是水与二氧化碳混合后塑料瓶的外形变化,说明二氧化碳能溶于水导致瓶内压强变小,塑料瓶被压瘪.
(4)碳酸盐与酸反应会生成相应的盐、水和二氧化碳,结合碳酸钙与盐酸的反应情况可写出碳酸钾与盐酸的反应.
故答案为:
(1)3Fe+2O2点燃Fe3O4;Al2O3;
(2)A;
(3)隔绝氧气(或空气)能灭火;二氧化碳能溶于水;
(4)K2CO3+2HCl=2KCl+H2O+CO2↑.
(2)在四个选项中只有氢氧化钠是由金属离子与氢氧根形成的化合物,因此它是碱,其它均不符合碱类特征.
(3)甲实验中烧杯的放与倒放其变化是对空气的隔绝与否,正放时氧气充足,倒放时氧气缺乏,从而使蜡烛燃烧或熄灭,所以结论是隔绝氧气能灭火;而乙实验则是水与二氧化碳混合后塑料瓶的外形变化,说明二氧化碳能溶于水导致瓶内压强变小,塑料瓶被压瘪.
(4)碳酸盐与酸反应会生成相应的盐、水和二氧化碳,结合碳酸钙与盐酸的反应情况可写出碳酸钾与盐酸的反应.
故答案为:
(1)3Fe+2O2点燃Fe3O4;Al2O3;
(2)A;
(3)隔绝氧气(或空气)能灭火;二氧化碳能溶于水;
(4)K2CO3+2HCl=2KCl+H2O+CO2↑.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目


