题目内容
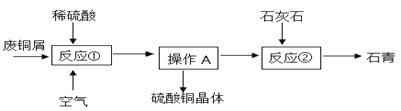
【题目】某化工厂用石灰石和铜屑等设计生产石青、波尔多液的工艺流程如下:
【产品制备】
(1)反应①在80℃条件下制备硫酸铜,其化学方程式为________,该化工厂后期发现,可用纯氧代替空气,既能加快反应速率又能________。
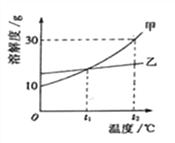
(2)硫酸铜晶体(CuSO45H2O)的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
操作A具体过程是:除杂,______、降温到30℃结晶、过滤、冰水洗涤、低温烘干。过滤时玻璃棒的作用是_____,剩余硫酸铜溶液的溶质质量分数为______,用冰水洗涤的目的是:Ⅰ是除去晶体表面的杂质;Ⅱ是______。
(3)车间将CuSO4·5H2O、生石灰分别与水按1:50的质量比混合,然后把得到的两种液体在木桶里来配制波尔多液,该过程发生的化合反应的方程式为_________。
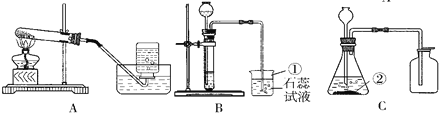
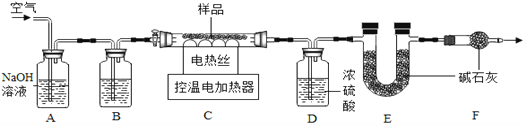
【组成测定为测定其组成】小组同学称取石青样品,用如图装置进行实验。
查阅资料:①石青的化学式可表示为aCuCO3b Cu(OH)2;②Cu(OH)2在66℃~68℃完全分解:Cu(OH)2![]() CuO+H2O; CuCO3在200℃~220℃完全分解:CuCO3
CuO+H2O; CuCO3在200℃~220℃完全分解:CuCO3![]() CuO+CO2↑;③CuSO4固体为白色,CuSO45H2O固体为蓝色
CuO+CO2↑;③CuSO4固体为白色,CuSO45H2O固体为蓝色
实验步骤:①连接仪器, ,准确称取34.6g aCuCO3bCu(OH)2放在C装置中;②打开活塞鼓入一段时间空气,称量装置D、E的质量;③关闭活塞,控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止;④打开活塞, ;⑤冷却后,称量,装置D增重1.8g,装置E增重8.8g。
(4)完善实验步骤中的填空:①________;④__________。
(5)洗气瓶A中氢氧化钠溶液的作用是______;B中所装液体为______(填名称)。
(6)通过计算可得:a:b=__________。(写出实验过程2分)
(7)若缺少F装置,测得的a:b________(选填“偏大”、“偏小”、“不变”)。
【脱水探究】
硫酸铜晶体受热会逐步失去结晶水。取纯净CuSO45H2O固体2.50g,放在上图实验装置C中进行加热,测定固体质量随温度的变化情况如图所示。
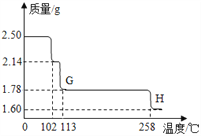
(8)G点固体的化学式是_________。
(9)G→H看到的现象是_________。
(10)将CuSO45H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:_________。
【答案】 2Cu+O2+2H2SO4 ![]() 2CuSO4+2H2O 防止不反应的氮气带出热量 蒸发浓缩 引流 20℅ 减少硫酸铜晶体溶解损失 CuSO4+Ca(OH)2=Cu(OH)2 ↓+CaSO4 检查装置的气密性 缓缓鼓入一段时间空气 吸收空气中的二氧化碳 浓硫酸 a:b=2:1 偏大 CuSO4H2O 变白 CuSO45H2O
2CuSO4+2H2O 防止不反应的氮气带出热量 蒸发浓缩 引流 20℅ 减少硫酸铜晶体溶解损失 CuSO4+Ca(OH)2=Cu(OH)2 ↓+CaSO4 检查装置的气密性 缓缓鼓入一段时间空气 吸收空气中的二氧化碳 浓硫酸 a:b=2:1 偏大 CuSO4H2O 变白 CuSO45H2O![]() CuO+SO3↑+5H2O↑
CuO+SO3↑+5H2O↑
【解析】用石灰石和铜屑等设计生产石青、波尔多液。根据所学知识和题中信息知,(1)反应①在80℃条件下制备硫酸铜,其化学方程式为2Cu+O2+2H2SO4 ![]() 2CuSO4+2H2O。该化工厂后期发现,可用纯氧代替空气,既能加快反应速率又能防止不反应的氮气带出热量。(2)由图表信息知,操作A具体过程是:除杂,蒸发浓缩、降温到30℃结晶、过滤、冰水洗涤、低温烘干。过滤时玻璃棒的作用是引流,30℃时硫酸铜晶体溶解度是25g,剩余硫酸铜溶液为饱和溶液,其溶质质量分数为∶
2CuSO4+2H2O。该化工厂后期发现,可用纯氧代替空气,既能加快反应速率又能防止不反应的氮气带出热量。(2)由图表信息知,操作A具体过程是:除杂,蒸发浓缩、降温到30℃结晶、过滤、冰水洗涤、低温烘干。过滤时玻璃棒的作用是引流,30℃时硫酸铜晶体溶解度是25g,剩余硫酸铜溶液为饱和溶液,其溶质质量分数为∶![]() ×100%=20%。用冰水洗涤的目的是:Ⅰ是除去晶体表面的杂质;Ⅱ是减少硫酸铜晶体溶解损失,温度低,硫酸铜溶解度小。(3)车间将CuSO4·5H2O、生石灰分别与水按1:50的质量比混合,然后把得到的两种液体在木桶里来配制波尔多液,该过程发生的化合反应的方程式为CuSO4+Ca(OH)2=Cu(OH)2 ↓+CaSO4。【测定其组成】(4)完善实验步骤中的填空:①检查装置的气密性;④缓缓鼓入一段时间空气。(5)洗气瓶A中氢氧化钠溶液的作用是吸收空气中的二氧化碳,二氧化碳与氢氧化钠溶液反应生成碳酸钠和水;B中所装液体为浓硫酸,浓硫酸具有吸水性,可以吸附空气中的水蒸气;(6)通过计算可得:CuCO3→CO2,98→44,
×100%=20%。用冰水洗涤的目的是:Ⅰ是除去晶体表面的杂质;Ⅱ是减少硫酸铜晶体溶解损失,温度低,硫酸铜溶解度小。(3)车间将CuSO4·5H2O、生石灰分别与水按1:50的质量比混合,然后把得到的两种液体在木桶里来配制波尔多液,该过程发生的化合反应的方程式为CuSO4+Ca(OH)2=Cu(OH)2 ↓+CaSO4。【测定其组成】(4)完善实验步骤中的填空:①检查装置的气密性;④缓缓鼓入一段时间空气。(5)洗气瓶A中氢氧化钠溶液的作用是吸收空气中的二氧化碳,二氧化碳与氢氧化钠溶液反应生成碳酸钠和水;B中所装液体为浓硫酸,浓硫酸具有吸水性,可以吸附空气中的水蒸气;(6)通过计算可得:CuCO3→CO2,98→44,![]() =
=![]() ,x=24.8g;Cu(OH)2→H2O,98→18,
,x=24.8g;Cu(OH)2→H2O,98→18,![]() =
=![]() ,y=9.8g; a:b=
,y=9.8g; a:b=![]() ∶
∶![]() =2∶1。(7)若缺少F装置,E装置质量增加,a值偏大,测得的a:b偏大。【脱水探究】硫酸铜晶体受热会逐步失去结晶水。由图中信息知,(8)G点固体的化学式是CuSO4H2O,CuSO45H2O固体2.50g,其中含水0.9g,G点固体质量减少为2.50g-1.78g=0.72g,硫酸铜晶体中含有水0.9g-0.72g=0.18g,硫酸铜质量为1.78g-0.18g=1.60g,硫酸铜晶体中硫酸铜和水分子个数比是1∶1。(9)G→H看到的现象是变白,硫酸铜晶体是蓝色,无水硫酸铜是白色,H时硫酸铜晶体已完全失去水。(10)将CuSO45H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:CuSO45H2O
=2∶1。(7)若缺少F装置,E装置质量增加,a值偏大,测得的a:b偏大。【脱水探究】硫酸铜晶体受热会逐步失去结晶水。由图中信息知,(8)G点固体的化学式是CuSO4H2O,CuSO45H2O固体2.50g,其中含水0.9g,G点固体质量减少为2.50g-1.78g=0.72g,硫酸铜晶体中含有水0.9g-0.72g=0.18g,硫酸铜质量为1.78g-0.18g=1.60g,硫酸铜晶体中硫酸铜和水分子个数比是1∶1。(9)G→H看到的现象是变白,硫酸铜晶体是蓝色,无水硫酸铜是白色,H时硫酸铜晶体已完全失去水。(10)将CuSO45H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:CuSO45H2O![]() CuO+SO3↑+5H2O↑。
CuO+SO3↑+5H2O↑。
点睛∶Cu(OH)2![]() CuO+H2O; CuCO3在200℃~220℃完全分解:CuCO3
CuO+H2O; CuCO3在200℃~220℃完全分解:CuCO3![]() CuO+CO2↑。CuSO4固体为白色,CuSO45H2O固体为蓝色。浓硫酸具有吸水性,碱石灰可以吸收水分和二氧化碳。
CuO+CO2↑。CuSO4固体为白色,CuSO45H2O固体为蓝色。浓硫酸具有吸水性,碱石灰可以吸收水分和二氧化碳。

【题目】馒头、面包等发面食品在制作时都需使用发酵粉,发酵粉的主要成分最常见的是碳酸钠、碳酸氢钠等。某兴趣小组的同学对制作馒头用的发酵粉(白色粉末)进行探究。
【提出问题】白色粉末成分是什么?
【进行猜想】 猜想Ⅰ:碳酸钠 ; 猜想Ⅱ:碳酸氢钠; 猜想Ⅲ:__________________。
【初步探究】取少量白色粉末于试管中,加适量水,测得溶液的 pH=10.5,说明溶液呈________性。
【查阅资料】
(1)碳酸氢钠受热易分解,该反应可表示为2NaHCO3 ![]() Na2CO3+CO2↑+H2O;而碳酸钠很稳定,受热不易分解。
Na2CO3+CO2↑+H2O;而碳酸钠很稳定,受热不易分解。
(2)参照实验:
NaHCO3稀溶液 | Na2CO3稀溶液 | |
加入稀盐酸 | 产生气泡 | 产生气泡 |
加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 |
【实验探究】:
甲、乙、丙三位同学分别设计三种不同实验方案进行探究。

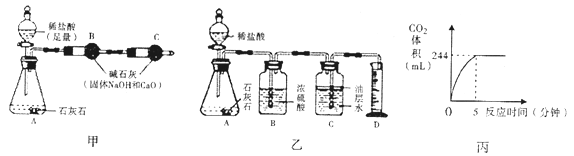
甲同学方案:如图1,取适量发酵粉在铜片上加热,加热一段时间后,观察到烧杯内壁有液滴出现,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到_____________。甲得出结论: 猜想Ⅱ正确。
乙同学方案:
实验步骤 | 实验现象 | 实验结论 |
①取少量发酵粉于加足量水后形成的无色稀溶液,再加入过量CaCl2溶液,静置。 | 有白色沉淀产生 | 化学方程式 __________。 |
②再取步骤①的上层清液,加入稀盐酸 | 有气泡冒出 | 该清液中含 ____________。 |
乙得出结论: 猜想Ⅲ正确。
丙同学方案:用如图2所示,锥形瓶中分别盛有等质量的碳酸钠、碳酸氢钠和发酵粉,再注入等体积、等浓度的足量的稀硫酸,准确测量生成气体的体积。

记录如表:
实验 编号 | 锥形瓶内物质 | 最终得到 CO2 体积/mL | |
名称 | 质量/g | ||
① | 碳酸钠 | a | V1 |
② | 碳酸氢钠 | a | V2 |
③ | 发酵粉 | a | V3 |
【实验结论】经同学们讨论,最终确认:该发酵粉是碳酸钠和碳酸氢钠的混合物。
【反思应用】
(1)同学们讨论时认为:甲同学方案不严密的原因是_____________________________。
(2)乙同学方案中,实验①中加入CaCl2溶液要过量的目的是____________________。
(3)丙同学方案也能得到正确结论应满足的条件是_____________________________。
(4)制作馒头、面包时,将面粉发酵(产生有机酸),再加入适量的碳酸氢钠,可以使馒头、面包松软。原因是________________。
(5)将12.0g该白色粉末加热至完全反应,剩余固体的质量为8.9g,计算该白色粉末中Na2CO3的质量分数为 _________________。(写出计算过程)