题目内容
黄铜是铜和锌的合金,可以用来制造机器、电器零件及日常用品.为了测定某黄铜样品中铜的质量分数,取20g该样品向其中加入一定量的10%的稀硫酸,恰好完全反应,产生氢气0.2g.
(1)该黄铜样品中铜的质量分数;
(2)完全反应后所得溶液的质量分数.
解:设合金中锌的质量为x,稀H2SO4中H2SO4的质量为y,硫酸锌的质量为z.
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
x y z 0.2g

解得:x=6.5g,y=9.8g;z=16.1g
铜的质量为20g-6.5g=13.5g;
铜的质量分数: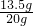 ×100%=67.5%
×100%=67.5%
(2)稀H2SO4的质量为:9.8g÷10%=98g;
反应后溶液的质量:6.5g+98g-0.2g=104.3g
完全反应后所得溶液的质量分数为: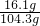 ×100%=15.4%
×100%=15.4%
答:(1)该黄铜样品中铜的质量分数为67.5%;
(2)完全反应后所得溶液的质量分数为15.4%.
分析:(1)利用锌与稀硫酸反应的化学方程式和生成氢气的质量,列出比例式,就可计算出该黄铜样品中锌的质量;样品质量-该黄铜样品中锌的质量=该黄铜样品中铜的质量,然后根据质量分数公式计算即可.
(2)反应后所得溶液中的溶质是硫酸锌,可根据氢气的质量求出,所得溶液的质量=锌的质量+稀硫酸的质量(根据氢气的质量求出硫酸的质量),然后根据溶液中溶质的质量分数的计算公式进行计算即可.
点评:有关反应后所得溶液的计算是初中化学的一个重点,计算方法一般是:所加入的所有物质的质量总和-生成沉淀的质量-生成气体的质量.
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
x y z 0.2g

解得:x=6.5g,y=9.8g;z=16.1g
铜的质量为20g-6.5g=13.5g;
铜的质量分数:
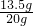 ×100%=67.5%
×100%=67.5%(2)稀H2SO4的质量为:9.8g÷10%=98g;
反应后溶液的质量:6.5g+98g-0.2g=104.3g
完全反应后所得溶液的质量分数为:
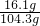 ×100%=15.4%
×100%=15.4%答:(1)该黄铜样品中铜的质量分数为67.5%;
(2)完全反应后所得溶液的质量分数为15.4%.
分析:(1)利用锌与稀硫酸反应的化学方程式和生成氢气的质量,列出比例式,就可计算出该黄铜样品中锌的质量;样品质量-该黄铜样品中锌的质量=该黄铜样品中铜的质量,然后根据质量分数公式计算即可.
(2)反应后所得溶液中的溶质是硫酸锌,可根据氢气的质量求出,所得溶液的质量=锌的质量+稀硫酸的质量(根据氢气的质量求出硫酸的质量),然后根据溶液中溶质的质量分数的计算公式进行计算即可.
点评:有关反应后所得溶液的计算是初中化学的一个重点,计算方法一般是:所加入的所有物质的质量总和-生成沉淀的质量-生成气体的质量.

练习册系列答案
相关题目