题目内容
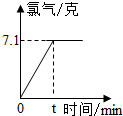 氯化钠是一种重要的化工原料.电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应为:2NaCl+2H2O
氯化钠是一种重要的化工原料.电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应为:2NaCl+2H2O
| ||
(1)参加反应的氯化钠是多少克?生成氢气多少?
(2)完全反应后所得溶液中溶质的质量分数是多少?
分析:(1)题干中有NaCl溶液电解的化学方程式,根据方程式由图中所给的氯气质量可直接求出参加反应的NaCl质量和H2质量;
(2)根据NaCl溶液电解的化学方程式,利用氯气质量可得到生成的氢氧化钠的质量,进而求出氢氧化钠的质量分数.
(2)根据NaCl溶液电解的化学方程式,利用氯气质量可得到生成的氢氧化钠的质量,进而求出氢氧化钠的质量分数.
解答:解:(1)设参加反应的NaCl的质量为x,生成H2的质量为y
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
117 71 2 80
x 7.1g y z
=
,x=11.7g
=
,y=0.2g
(2)设完全反应后生成的NaOH的质量为z
=
z=8g
氯化钠溶液质量为11.7g÷10%═117g
完全反应后NaOH溶液中NaOH的质量分数为:
×100%≈7.3%
答:(1)参加反应的氯化钠是11.7克,生成的氢气是0.2克;
(2)完全反应后所得溶液中溶质的质量分数约是7.3%.
2NaCl+2H2O
| ||
117 71 2 80
x 7.1g y z
| 117 |
| 71 |
| x |
| 7.1g |
| 71 |
| 2 |
| 7.1g |
| y |
(2)设完全反应后生成的NaOH的质量为z
| 71 |
| 80 |
| 7.1g |
| z |
z=8g
氯化钠溶液质量为11.7g÷10%═117g
完全反应后NaOH溶液中NaOH的质量分数为:
| 8g |
| 117g-7.1g-0.2g |
答:(1)参加反应的氯化钠是11.7克,生成的氢气是0.2克;
(2)完全反应后所得溶液中溶质的质量分数约是7.3%.
点评:此题是利用化学方程式的计算题,因为解题所需的方程式已经给出,使难度降低了很多,另外要熟记溶质质量分数的公式.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
 (2013?朝阳区一模)钠元素对人类生命和生活具有重要意义.
(2013?朝阳区一模)钠元素对人类生命和生活具有重要意义.
 钠元素对人类生命和生活具有重要意义.
钠元素对人类生命和生活具有重要意义.
