题目内容
【题目】A~G七种物质之间具有如下图所示的转化关系.已知:A是一种含铁的矿石的主要成分,其中金属与非金属元素的原子个数比为1:2;B中铁的质量分数为70%,C是有刺激性气味的无色气体,它是形成酸雨的物质之一;F可溶于G的稀溶液并产生气体,该气体是有利于环境保护的理想燃料.请回答下列问题: 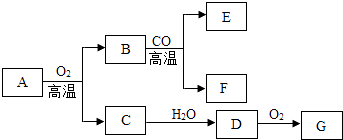
①A的化学式为 , 已知A转化为B时金属元素的化合价升高,则A中非金属元素的化合价是
②B与CO反应的化学方程式是 .
③C→D反应的化学方程式是 .
④B与G的稀溶液反应的化学方程式是
【答案】FeS2;﹣1;Fe2O3+3CO ![]() 2Fe+3CO2;SO2+H2O=H2SO3;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
2Fe+3CO2;SO2+H2O=H2SO3;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
【解析】解:根据题中信息“C是有刺激性气味的无色气体,它是形成酸雨的物质之一”可得出C是SO2 , 由C溶于水生成D,SO2+H2O=H2SO3 , 可得出D是H2SO3;由D和氧气反应生成G,2H2SO3+O2=2H2SO4 , 可推出G是H2SO4; 根据A是含铁的矿石的成分和C是SO2可推出A中含Fe和S两种元素,根据“A中金属与非金属元素的原子个数比为1:2”,可推出A的化学式为FeS2 , 燃烧A的反应式为4FeS2+11O2 ![]() 2Fe2O3+8SO2 , 根据B中铁的质量分数为70%,验证正好是三氧化二铁,在Fe2O3中铁的化合价为+3,所以在FeS2中铁的化合价为+2价,根据化合价代数和为零的原则可知S元素的化合价为﹣1价;
2Fe2O3+8SO2 , 根据B中铁的质量分数为70%,验证正好是三氧化二铁,在Fe2O3中铁的化合价为+3,所以在FeS2中铁的化合价为+2价,根据化合价代数和为零的原则可知S元素的化合价为﹣1价;
B在高温下和CO反应将铁还原为单质,方程式为Fe2O3+3CO ![]() 2Fe+3CO2 , 所以B和G反应,方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
2Fe+3CO2 , 所以B和G反应,方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
所以答案是:(1)FeS2;﹣1(2)Fe2O3+3CO ![]() 2Fe+3CO2(3)SO2+H2O=H2SO3(4)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
2Fe+3CO2(3)SO2+H2O=H2SO3(4)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号.

【题目】某化学兴趣小组用下图装置进行Na2CO3的性质实验. 【实验装置】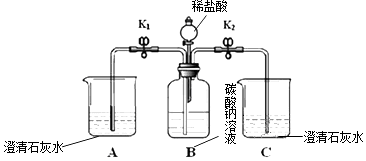
【实验记录】
实验步骤 | 实验现象 | 实验结论 | |
Ⅰ | 向B瓶中滴入几滴酚酞试液 | B瓶中溶液变红 | Na2CO3溶液呈性 |
Ⅱ | 关闭开关K1 , 打开K2 , 并加入一定量稀盐酸 | B中有气泡;C中 | Na2CO3与稀盐酸反应 |
Ⅲ | 关闭开关K2 , 打开K1 | ①B瓶中液体压入A中 | A中发生反应的化学方程式: |
【反思与交流】
①实验后,同学们分析实验Ⅲ中B瓶溶液的溶质为 .
②某同学向B瓶中继续加入稀盐酸,发现A中白色沉淀消失且红色褪去,白色沉淀消失的原因为(用化学方程式表示).
