题目内容
【题目】氯化钠是重要的调味品。如图分别表示生成氯化钠的不同化学反应,请根据图示回答相关问题:
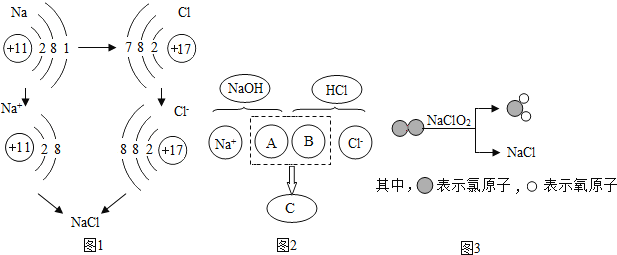
①图1是金属钠与氯气反应生成氯化钠的微观示意图.由图1可知,元素的化学性质与________(填字母序号)密切相关。
A最外层电子数 B质子数 C电子层数
②图2描述了氢氧化钠溶液与盐酸反应的微观实质,图中A、B、C三处中B处应填入的化学符号是________。
③图3所示物质NaClO2中氯元素的化合价是______,该反应的化学方程式是_________。
【答案】A H+ +3 ![]()
【解析】
元素的化学性质与元素原子最外层电子数密切相关;故填:A
②氢氧化钠和盐酸反应的实质是氢离子和氢氧根离子结合生成了水分子,B处是盐酸电离出来的氢离子;故填:H+
③在NaClO2中,钠元素是+1价,氧元素是-2价,设氯元素的化合价是x,则有(+1)+x+(-2)×2=0,x=+3;据图可以看出,该反应是 Cl2和NaClO2反应生成了ClO2和NaCl,故填:+3,![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】元素周期表是学习化学的重要工具。下表中列出了部分元素的原子序数,回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
第一周期 | 1 | 2 | ||||||
第二周期 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
第三周期 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | Ar |
(1)表中铝元素原子的核内质子数为________。
(2)18号元素的原子结构示意图为________。
(3)9号和12号元素形成的化合物的化学式为________。
(4)下图是某化学反应的微观示意图,该反应的化学方程式为________。
【题目】如表是硝酸钾、氯化钠在不同温度下的溶解度.
温度/℃ | 10 | 20 | 30 | 40 | 50 |
硝酸钾的溶解度/g | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |
氯化钠的溶解度/g | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
(1)从表中数据分析,溶解度受温度影响较大的物质是__________,硝酸钾和氯化钠溶解度曲线的交点在 __________(填字母序号)之间.
A.20℃~30℃ B.30℃~40℃ C.40℃~50℃
(2)20℃,将50g硝酸钾与100g水混合,充分搅拌后静置,得到的溶液是硝酸钾的__________(“饱和”或“不饱和”)溶液,若将温度升高到40℃,该溶解溶质的质量分数为__________(精确到0.1%).
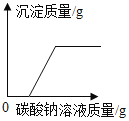
(3)保持温度为20℃,将氯化钠的不饱和溶液变成饱和溶液,写出一种可行的方法__________。
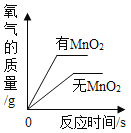
【题目】过碳酸钠(化学式为2Na2CO33H2O2)俗名固体双氧水。溶于水可看作是Na2CO3溶液和H2O2溶液混合。为了方便保存,过碳酸钠样品可能添加少量的MgSO4和硅酸镁中的一种或二种作为稳定剂。已知①双氧水可用于供氧、消毒和漂白;②硅酸镁不溶于水。
(1)过碳酸钠的用途不合理的是____。
A 鱼池供氧剂 B 消毒剂 C 干燥剂 D 漂白剂
(2)在“过碳酸钠”中加入下列物质时,不会导致“过碳酸钠”变质___(填序号)。
A 二氧化锰 B 稀盐酸 C 硫酸钠 D 石灰水
(3)取少量过碳酸钠样品于烧杯中,加入足量蒸馏水,有不溶于水的固体产生。判断样品中__有硅酸镁。(填写“可能”或“一定”)
(4)利用实验室限选试剂,设计实验确定该样品中是否添加少量的MgSO4。
限选试剂:稀盐酸、稀H2SO4、BaCl2溶液、蒸馏水、AgNO3溶液
实验操作 | 预期现象和必要结论 |
步骤1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤。 |
|
步骤2:取少量步骤1所得的滤液于试管中,加入_______,振荡后静置。 | _______。 |
步骤3:取少量步骤2所得的溶液液于试管中,_______________。 | ____,说明样品中有MgSO4。 ___,说明样品中没有MgSO4。 |
思考:步骤2中,加该试剂的目的是:_____。