题目内容
【题目】右图是氢气与氧化铜反应的微型实验装置图。眼药水瓶的作用相当于仪器 ,实验过程中发现导管中的黑色粉末变红色,结合右图装置所示,说明氢气具有的化学性质是 、 。
【答案】分液漏斗 可燃性 还原性
【解析】
试题分析:实验室用锌和稀硫酸反应制取氢气,氢气具有还原性,能将氧化铜还原成铜,该反应的现象是黑色的粉末变成红色;氢气还具有可燃性,氢气燃烧生成的是水,是最清洁的燃料。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】某化学兴趣小组的同学无意中向2mL10%的氯化钙溶液中滴加氢氧化钠溶液,出现了白色沉淀。
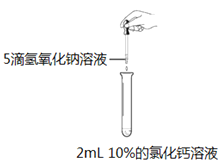
【提出问题】观察到白色沉淀的原因是什么?
【猜想假设】猜想Ⅰ:氢氧化钠溶液变质,产生的白色沉淀是_______;
猜想Ⅱ:氢氧化钠溶液浓度较大,产生的白色沉淀是氢氧化钙。
【进行实验】甲组同学针对猜想Ⅰ进行实验。
实验步骤 | 实验现象 | 实验结论 |
将浑浊液过滤,取少量滤渣于烧杯中,加入足量水,再滴入2滴酚酞溶液 | _________ | 猜想Ⅰ不成立 |
乙组同学提出在甲组实验基础上,从研究滤液的角度也可以证明氢氧化钙的存在,他们将滤液进行加热,观察到___________,从而验证了自己的设想。
丙组同学针对猜想Ⅱ进行实验。
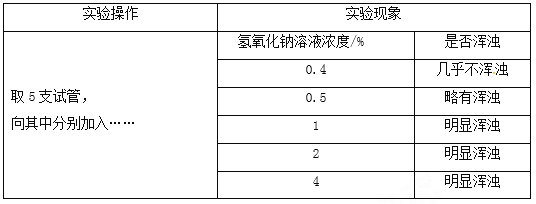
【解释与结论】(1)补全上述实验操作:取5支试管,向其中分别加入____________;
(2)丙组实验证明猜想Ⅱ成立,能否出现浑浊与氢氧化钠溶液浓度有关,其关系是______;
【反思评价】你认为氯化钙溶液与氢氧化钠溶液产生白色沉淀的原因还可能是__________。
【题目】我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品。小华利用一瓶稀盐酸和相关的仪器,测定黄铜样品的组成(不考虑黄铜中的其他杂质)。将30mL稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
第一次 | 第二次 | 第三次 | |
连续加入盐酸的体积/mL | 10 | 10 | 10 |
生成氢气的质量/g | 0.08 | X | 0.04 |
(1)X=____________;
(2)从上表数据分析,小华用10 g合金粉末总共收集到氢气_______g;
(3)求该合金中铜的质量分数。