题目内容
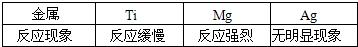
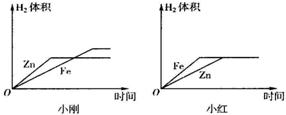
等质量的锌、铁、镁分别与足量的稀硫酸完全反应后生成氢气的质量( )
分析:等质量的金属与稀硫酸反应时,生成氢气质量的多少,可以通过经验公式氢气的质量=
×金属的质量进行分析解答;
| 金属的化合价 |
| 金属的相对原子质量 |
解答:解:由于锌、铁、镁与硫酸反应时的化合价都是+2价,而三者质量相等,所以根据氢气的质量=
×金属的质量可知,三种金属中原子量越小则生成的氢气越多,因此依据锌、铁、镁的原子量分别是65、56、24可得三者生成氢气的质量顺序是镁>铁>锌;
故选C
| 金属的化合价 |
| 金属的相对原子质量 |
故选C
点评:本题的关键是将化学方程式计算转化为相对原子质量与化合价的比值大小的比较,主要依靠平时学习的有关经验完成.

练习册系列答案
相关题目