题目内容
【题目】设计实验和数据分析是学习化学重要的能力。
①利用酚酞溶液和氢氧化钠溶液,合理设计一个实验证明同浓度的浓盐酸敞口放置比密封的浓度变小了。_____。
②乙同学取20%的氢氧化钠溶液20.00g,敞口放置一段时间后部分变质,得到18.80g溶液,将变质后溶液加热蒸干,称量所得固体质量为a,求a的取值范围_____。
【答案】取两支试管,分别加入同一氢氧化钠溶液等量,分别加入相同滴数的酚酞试液,然后分别滴入敞口放置的浓盐酸和密封放置的浓盐酸,直到溶液恰好红色消失,记录所加盐酸的滴数,滴数越多证明浓度越低。 4.00~5.30。
【解析】
①涉及实验注意控制变量,以便对比;
②根据氢氧化钠的质量和对应的化学方程式求算生成的碳酸钠的质量,进而确定a 的取值范围。
①利用酚酞溶液和氢氧化钠溶液,合理设计一个实验证明同浓度的浓盐酸敞口放置比密封的浓度变小了,则需要控制变量以便进行对比。具体操作为:取两支试管,分别加入同一氢氧化钠溶液等量,分别加入相同滴数的酚酞试液,然后分别滴入敞口放置的浓盐酸和密封放置的浓盐酸,直到溶液恰好红色消失,记录所加盐酸的滴数,滴数越多证明浓度越低。
②氢氧化钠的质量为20%×20.00g=4.00g
设氢氧化钠完全变质生成的碳酸钠的质量为x
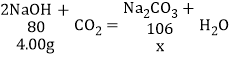
![]()
x=5.30g
由于是部分变质,所以a介于4.00g与5.30之间。
所以a为4.00∽5.30
故答案为:
①取两支试管,分别加入同一氢氧化钠溶液等量,分别加入相同滴数的酚酞试液,然后分别滴入敞口放置的浓盐酸和密封放置的浓盐酸,直到溶液恰好红色消失,记录所加盐酸的滴数,滴数越多证明浓度越低。
②4.00∽5.30。

【题目】用煤直接做燃料如果不进行处理,会因煤中的硫生成SO2气体造成大气污染。常用两种方法治污,其一在煤中混入粉末状的石灰石,则燃烧产生的SO2会与CaCO3反应生成CaSO3进入炉渣而减少大气污染。其二向燃烧后的烟气喷洒石灰浆也可吸收SO2生成CaSO3。
(1)现用10000元分别购买两种原料来除去SO2,相关数据如下表:
方法 | 物质 | 相对分子质量 | 纯度 | 价格(元/t) | 除SO2的量/t |
A | 石灰石 | 100 | 90% | 200 | 0.288 |
B | 熟石灰 | 74 | 94% | 500 | 0.73 |
工业上多数采用方法B除SO2.其原因有两个分别是:_____;_____。
(2)取50g此炉渣(含24% CaSO3)逐滴加入20%的盐酸,请求出氯化钙和盐酸的相关数据,并在坐标图中画出相应的曲线图(纵坐标为氯化钙的质量,横坐标为盐酸的质量,标出曲线中必要的数据)。_____。
已知:①设炉渣已不含石灰石,炉渣其它成分不与盐酸反应;
②CaSO3和盐酸反应类似于CaCO3。

【题目】某同学对若干块矿石样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应).请计算:
序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
第1次 | 10 | 5.5 |
第2次 | 10 | m |
第3次 | 10 | 1.2 |
第4次 | 10 | 1.2 |
(1)8g的石灰石样品中含有杂质 克?
(2)如表中m的数值应为 ?
(3)稀盐酸的质量分数是多少?