题目内容
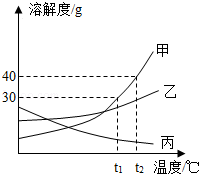
海水晒盐能够得到粗盐和卤水。卤水中含有MgCl2、KCl和MgSO4等物质,如图是它们的溶解度曲线,完成下列填空。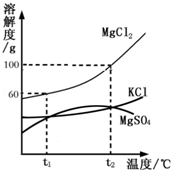
(1)在t1℃时,向100g水中加入150g MgCl2,形成 (填“饱和”或“不饱和”)溶液,将其温度升高到t2℃时,此时溶液中溶质的质量分数为 。
(2)t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是 。将t2℃时MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,可能会析出的晶体有 (填字母序号)。
A.MgCl2和KCl B.只有MgSO4 C.MgCl2、KCl和MgSO4
(1)饱和;50%;(2)MgCl2;C
解析试题分析:(1)据t1℃、t2℃时MgCl2的溶解度及溶质的质量分数计算式分析解答。t1℃时MgCl2的溶解度是60g,所以向100g水中加入150g MgCl2,最多溶解60g溶质,形成饱和溶液,t2℃时MgCl2的溶解度是100g,温度升高到t2℃时溶质依然不能全部溶解,溶质的质量分数是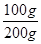 ×100%=50%;
×100%=50%;
(2)根据饱和溶液的质量分数的影响因素和降温后溶解度的变化考虑。饱和溶液溶质质量分数的计算方法是: ×100%,所以溶解度大的,溶质质量分数就大,所以t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是氯化镁;将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,只要溶解度减小的都能析出晶体,由图示可知三种物质的溶解度都变小,都能析出晶体。
×100%,所以溶解度大的,溶质质量分数就大,所以t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是氯化镁;将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,只要溶解度减小的都能析出晶体,由图示可知三种物质的溶解度都变小,都能析出晶体。
考点:考查固体溶解度曲线及其作用;晶体和结晶的概念与现象;溶质的质量分数、溶解性和溶解度的关系

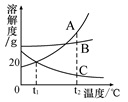
下图为NaCl、KNO3的溶解度曲线,下列说法正确的是
| A.KNO3的溶解度一定大于NaCl溶解度 |
| B.20℃时,50g水最多能溶解31.6gKNO3 |
| C.t℃时,NaCl和KNO3的饱和溶液的溶质质量分数相等 |
| D.50℃的NaCl饱和溶液降温到20℃时变成不饱和溶液 |
高铁酸钠(Na2FeO4)是一种新型高效的水处理剂。下列有关高铁酸钠的说法正确的是
| A.属于氧化物 | B.钠、铁、氧三种元素质量比是2:1:4 |
| C.铁元素化合价为+6 | D.由两种金属和一种非金属组成 |