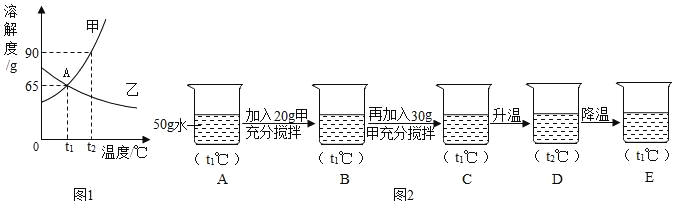
题目内容
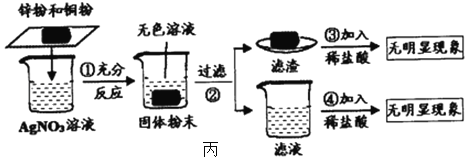
【题目】某废液中含有硫酸锌、硫酸镍(NiSO4)、硫酸铜和硫酸,初三化学兴趣小组欲从中回收铜和硫酸锌晶体。老师给出信息:硫酸锌的溶解度受温度变化影响较大;硫酸镍溶液呈绿色,硫酸锌溶液呈无色。
(1)为探究镍的金属活动性,同学们做了以下两个实验:
①将镍丝(Ni)插入稀硫酸中,观察到有气泡产生;
②将镍丝(Ni)插入硫酸锌溶液中,观察到镍丝上无固体附着物,溶液颜色没有发生变化。
请根据实验结果,把锌、铜、镍的元素符号填在下表的相应格中:
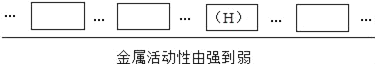
_____、_____、_____
(2)同学们按照实验目的设计了以下实验方案,请你协助完成详案:
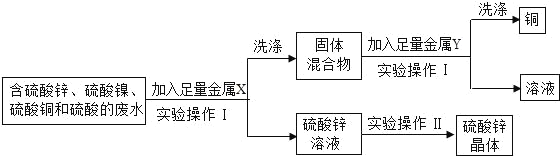
①X是_____,Y是_____。写出X与废水中的物质发生反应的其中一个化学方程式_____。
②实验操作Ⅰ的名称是_____;实验Ⅰ、Ⅱ操作中用到的相同的玻璃仪器是_____。
【答案】Zn Ni Cu Zn 稀硫酸或稀盐酸 Zn+H2SO4=ZnSO4+H2↑(或Zn+NiSO4=ZnSO4+Ni或Zn+CuSO4=ZnSO4+Cu) 过滤 玻璃棒
【解析】
金属和酸反应生成氢气的条件:金属必须是在金属活动性顺序中氢前的金属,酸除浓硫酸和硝酸外;金属和盐反应生成新的金属的条件:在金属活动性顺序中只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,钾、钙、钠除外。
(1)由于将镍丝(Ni)插入稀硫酸中,观察到有气泡产生,说明镍在氢前;将镍丝(Ni)插入硫酸锌溶液中,观察到镍丝上无固体附着物,溶液颜色没有发生变化,说明镍的活动性比锌弱,故答案为:Zn Ni Cu
(2)①从图中不难看出,在废水中加入足量的金属X得到的是硫酸锌溶液,说明加入的X应是金属锌,由于锌可以和废水中的硫酸镍、硫酸铜、硫酸反应,过滤后得到的固体混合物中一定含有金属镍、铜,可能还混有过量的锌,由于铜在氢后,不和稀酸反应,而镍和锌都可以和稀酸反应,因此溶液Y应是稀盐酸或稀硫酸,反应的化学方程式为
![]() (或
(或![]() 或
或![]() )。
)。
②由于实验操作Ⅰ把固体混合物和硫酸锌溶液分开,因此操作Ⅰ是过滤,而实验操作Ⅱ是从硫酸锌溶液中得到硫酸锌晶体,因此操作Ⅱ是蒸发结晶,故两个操作中都会用到玻璃棒。

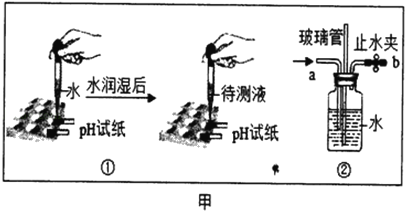
【题目】请结合图示实验装置,回答下列问题。
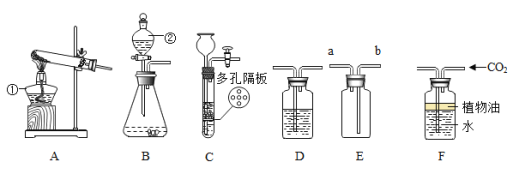
(1)写出有标号的仪器名称:②______。
(2)若用B装置制取CO2,要获得干燥的CO2,应先将气体通过盛有______的D装置,再用E装置收集,气体应从______端通入(选填“a”或“b”)。
(3)若用F装置收集CO2,油层的作用是______。
(4)为了测定石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水。)有关实验数据如下表:
反应前 | 反应后 | ||
实验 数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
150g | 12g | 157.6g | |
①根据质量守恒定律可知,反应中生成二氧化碳的质量为______g。
②该石灰石中碳酸钙的质量分数为______。