题目内容
【题目】工业盐酸中通常因溶有少量的 FeCl3而呈黄色,小红为测定某工业盐酸中 HCl 的含量进 行如下实验:取某工业盐酸 l00g,滴加一定溶质质量分数的 NaOH 溶液,测得加入 NaOH溶液质量与反应生成的沉淀质量关系如图所示,FeCl3与 NaOH 反应的化学方程式为FeCl3+3NaOH═Fe(OH)3↓+3NaCl.请回答下列问题:
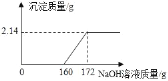
(1)FeCl3与 NaOH 恰好完全反应时,生成沉淀的质量是_____ g;
(2)所滴加的 NaOH 溶液质量为 160 克时,溶液中的溶质是_____;
(3)该工业盐酸中 HCl 的质量分数是多少?_____。
【答案】2.14g NaCl、FeCl3 29.2%
【解析】
解:(1)由图像可知,完全反应后生成沉淀的质量为2.14g;
(2)所滴加的 NaOH 溶液质量为160克时,氢氧化钠恰好与盐酸反应生成氯化钠和水,所以溶液中的溶质是生成的氯化钠和没参与反应的氯化铁;
(3)由图可知,与氯化铁反应的氢氧化钠溶液的质量为172g﹣160g=12g;
设消耗的氢氧化钠的质量为x。

![]() ,解得x=2.4g
,解得x=2.4g
氢氧化钠溶液的溶质质量分数为:![]() ×100%=20%
×100%=20%
与盐酸反应的氢氧化钠的质量为:160g×20%=32g
设工业盐酸中HCl的质量为y。
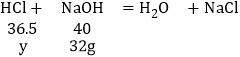
![]()
解得y=29.2g
该工业盐酸中HCl的质量分数是:![]() ×100%=29.2%
×100%=29.2%
答:该工业盐酸中HCl的质量分数是29.2%。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】云通过探究发现,氯酸钾与氧化铜(CuO)、氧化铁(Fe2O3)混合加热,也能较快产生氧气,于是进行如下探究:
(查阅资料)氯酸钾的熔点为356℃,常温下稳定,在400℃以上则分解产生氧气。酒精灯加热温度为400℃~500℃。
(提出猜想)除MnO2、CuO外,Fe2O3也可以作氯酸钾分解的催化剂。
(完成实验)按下表进行实验并测定分解温度。
实验编号 | 实验药品 | 分解温度 |
1 | 3.0g氯酸钾 | 460℃ |
2 | 3.0g氯酸钾和0.5g二氧化锰 | 248℃ |
3 | 3.0g氯酸钾和0.5g氧化铜 | 267℃ |
4 | 3.0g氯酸钾和Xg氧化铁 | 290℃ |
(分析数据,得出结论)
(1)实验3的化学反应式:______________________。
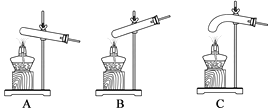
(2)小云从下图中选择该实验的最佳发生装置是__________。
(3)实验4中X的值应为__________,由实验__________与实验4对比,证明猜想合理。
(4)通过实验测得的数据,小云绘出了部分下图,请帮他完成该图。
(结论)通过该实验探究中,得到的结论有__________(填序号)。
A.催化剂可降低反应温度
B.二氧化锰只能催化氯酸钾的分解
C.催化剂的质量和性质在反应前后不变
D.催化剂可改变产物的质量
E.三种催化剂中,二氧化锰对氯酸钾分解催化效果最好