题目内容
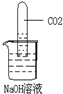 化学反应往往伴随着一些现象发生,但CO2与NaOH溶液的反应没有明显的现象.为了通过一些现象说明CO2与NaOH发生了反应,某班同学分两组作了如下探究实验:
化学反应往往伴随着一些现象发生,但CO2与NaOH溶液的反应没有明显的现象.为了通过一些现象说明CO2与NaOH发生了反应,某班同学分两组作了如下探究实验:(1)第一组同学把一支收集有CO2的试管倒立在装有饱和NaOH溶液的烧杯中(如图),看到试管内出现了
试管内液面升高
试管内液面升高
现象(2)同学们经过分析讨论,认为实验中产生液面上升现象的原因可能有两种.一种是因为CO2与溶液中的NaOH反应,消耗了CO2,你认为另一种原因是
二氧化碳溶于水
二氧化碳溶于水
.(3)为了进一步证实CO2与NaOH溶液已经发生了反应,他们设计了如下方案:
取上述实验后的溶液;第一组同学滴加
稀盐酸
稀盐酸
,现象为有气泡产生
有气泡产生
,反应方程式为2HCl+Na2CO3=2NaCl+H2O+CO2↑
2HCl+Na2CO3=2NaCl+H2O+CO2↑
;第二组同学滴加氯化钙
氯化钙
,现象为生成白色沉淀
生成白色沉淀
,反应方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
.他们虽然看到的现象不同,但都可以证实CO2与NaOH溶液已经发生了反应.分析:验证二氧化碳确实与氢氧化钠发生了反应,只需证明有碳酸钠产生即可.要证明有碳酸钠只需滴加盐酸,若有气泡产生说明二氧化碳确实与氢氧化钠发生了反应,生成了碳酸钠.
解答:解:(1)氢氧化钠吸收了二氧化碳气体,使试管内的压强小于大气压强,所以大气压压着液体进入试管.故填:试管内液面升高;
(2)二氧化碳不但能跟氢氧化钠反应,而且也能溶于水,故填:二氧化碳溶于水;
(3)二氧化碳与氢氧化钠反应生成了碳酸钠,所以可用盐酸来检验是否有碳酸钠,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,所以有气泡产生;也可用氯化钙来检验是否有碳酸钠生成,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,所以溶液变浑浊;故填:稀盐酸;有气泡产生;2HCl+Na2CO3=2NaCl+H2O+CO2↑;氯化钙;生成白色沉淀;CaCl2+Na2CO3=CaCO3↓+2NaCl;
(2)二氧化碳不但能跟氢氧化钠反应,而且也能溶于水,故填:二氧化碳溶于水;
(3)二氧化碳与氢氧化钠反应生成了碳酸钠,所以可用盐酸来检验是否有碳酸钠,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,所以有气泡产生;也可用氯化钙来检验是否有碳酸钠生成,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,所以溶液变浑浊;故填:稀盐酸;有气泡产生;2HCl+Na2CO3=2NaCl+H2O+CO2↑;氯化钙;生成白色沉淀;CaCl2+Na2CO3=CaCO3↓+2NaCl;
点评:二氧化碳与氢氧化钠发生的反应不属于初中任何一种基本反应类型.这是学生经常容易犯错误的地方.

练习册系列答案
相关题目




 28、化学反应往往伴随着发生一些现象,但CO2和NaOH溶液的反应没有明显现象发生.为了通过一些现象说明CO2和NaOH发生了现象说明CO2和NaOH发生了反应,某班同学分两种做了如下探究实验:
28、化学反应往往伴随着发生一些现象,但CO2和NaOH溶液的反应没有明显现象发生.为了通过一些现象说明CO2和NaOH发生了现象说明CO2和NaOH发生了反应,某班同学分两种做了如下探究实验:
