题目内容
 金属在生产和生活中有广泛的应用
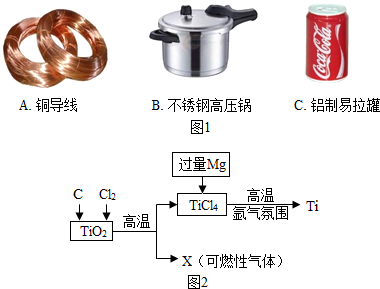
金属在生产和生活中有广泛的应用(1)下列金属制品中,利用金属导电性的是
B
B
(填字母序号)(2)收藏家收藏清朝末年的铝制品至今仍保存完好,原因是在常温下,其表面形成了一层致密的氧化铝薄膜:(用化学方程式表示)
4Al+3O2═2Al2O3
4Al+3O2═2Al2O3
.(3)铁制品在沙漠地区不易锈蚀的原因是
沙漠地区缺少水分
沙漠地区缺少水分
.(4)人们在焊接铁制品时先要用稀硫酸处理一下,其原理是(用化学方程式表示):
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
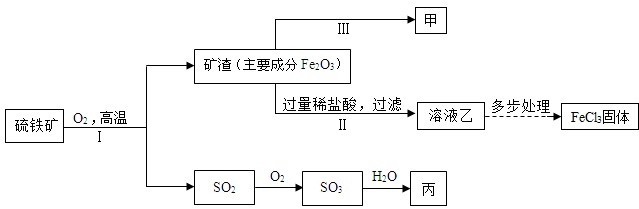
.(5)工业上用一氧化碳和赤铁矿炼铁的化学方程式为:
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
分析:(1)金属具有良好的导电性、导热性、延展性等;
(2)铝和氧气反应能生成氧化铝;
(3)铁与氧气和水充分接触时容易生锈,水和氧气同时存在是铁生锈的必要条件;
(4)稀硫酸和氧化铁反应能生成氯化铁和水;
(5)氧化铁和一氧化碳在高温条件下反应能生成铁和二氧化碳.
(2)铝和氧气反应能生成氧化铝;
(3)铁与氧气和水充分接触时容易生锈,水和氧气同时存在是铁生锈的必要条件;
(4)稀硫酸和氧化铁反应能生成氯化铁和水;
(5)氧化铁和一氧化碳在高温条件下反应能生成铁和二氧化碳.
解答:解:(1)金用作饰品是因为金具有特殊的光泽、化学性质稳定;铝用作水壶是因为铝具有良好的导热性;铜用作导线是因为铜具有良好的导电性.
故填:B.
(2)通常情况下,铝和氧气反应能生成氧化铝,反应的化学方程式为:4Al+3O2═2Al2O3.
故填:4Al+3O2═2Al2O3.
(3)因为沙漠地区缺少水分,所以铁制品在沙漠地区不易锈蚀.
故填:沙漠地区缺少水分.
(4)铁制品表面往往有一些铁锈,铁锈的主要成分是氧化铁,能和稀硫酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O.
故填:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O.
(5)氧化铁和一氧化碳在高温条件下反应能生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO
2Fe+3CO2.
故填:Fe2O3+3CO
2Fe+3CO2.
故填:B.
(2)通常情况下,铝和氧气反应能生成氧化铝,反应的化学方程式为:4Al+3O2═2Al2O3.
故填:4Al+3O2═2Al2O3.
(3)因为沙漠地区缺少水分,所以铁制品在沙漠地区不易锈蚀.
故填:沙漠地区缺少水分.
(4)铁制品表面往往有一些铁锈,铁锈的主要成分是氧化铁,能和稀硫酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O.
故填:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O.
(5)氧化铁和一氧化碳在高温条件下反应能生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO
| ||
故填:Fe2O3+3CO
| ||
点评:书写化学方程式时要注意四步,一是反应物和生成物的化学式要正确,二是遵循质量守恒定律,三是写上必要的条件,四是看是否有“↑”或“↓”.

练习册系列答案
相关题目

 (2013?玄武区二模)金属在生产和生活中有广泛的应用.
(2013?玄武区二模)金属在生产和生活中有广泛的应用. (2013?西城区二模)金属在生产和生活中有广泛的应用.
(2013?西城区二模)金属在生产和生活中有广泛的应用.