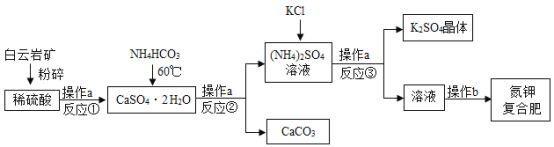
题目内容
【题目】将22.3g Na2CO3和NaCl混合物放入100g水中使其完全溶解,再加入86.1g CaCl2溶液,恰好完全反应,过滤后得滤液198.4g.计算:
(1)生成沉淀的质量是多少克?
(2)反应后所得溶液的溶质质量分数是多少?(计算精确到0.1%)
【答案】(1)10克(2)11.8%
【解析】
(1)由质量守恒定律可知,生成的碳酸钙的质量为:22.3g+86.1g+100g﹣198.4g=10g
(2)设生成的氯化钠的质量为x,混合物中碳酸钠的质量为y
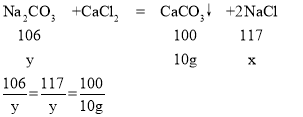
解得:x=11.7g y=10.6g
反应后所得溶液的溶质质量分数是:![]() ×100%≈11.8%
×100%≈11.8%
答:(1)生成沉淀的质量是10克,(2)反应后所得溶液的溶质质量分数为11.8%。

【题目】(7分)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
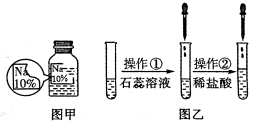
【猜想与假设】其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
【资料查阅】上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
【探究过程】
如图乙所示,在操作①后可确定溶质不是NaCl,则其实验现象应是 ;
在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的 。
【探究结论】
你认为该溶液中的溶质可能是上述假设物质中的 ,你的判断依据是 。
【探究反思】
(1)若上述探究结论是正确的,操作②产生的气体应是 (写化学式),实验室检验该气体的实验操作及现象是 。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由: 。