题目内容
某学习小组对用碳酸盐可以制取CO2进行如下研究:(1)向盛有等质量块状纯碱固体和块状碳酸钙固体的两装置中同时分别加入足量的相同质量相同浓度的稀盐酸,测得生成的CO2质量与时间关系如下表.
| 生成CO2质量/g | 2 | 4 | 6 | 8 | 12 | |
| 时间/s | 块状碳酸钙固体 | 10 | 25 | 40 | 60 | 85 |
| 块状纯碱晶体 | 4 | 9 | 15 | 25 | 40 | |
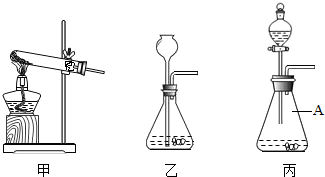
②如图是一组实验装置,该实验除用到电子秤外,还需用如中______装置(填所选装置编号).
③实验中小红同学用沾有紫色石蕊试液的玻璃棒放在 所选装置的导管口检验生成的气体,观察到的现象为______,由此她认为产生的气体为CO2.小军同学认为小红同 学的验证不严密,理由是______.
④请写出块状碳酸钙固体与稀盐酸反应方程式为______.
⑤由上表数据可知,若用块状纯碱晶体代替块状石灰石制取CO2,为保证实验时间接近,所用稀盐酸质量分数需______(选填“变大”、“变小”或“不变”).
(2)若需制取较纯净的CO2,则最好选择下列哪组药品?______,因为:______.
A.块状石灰石与稀盐酸 B.块状石灰石与稀硫酸
C.块状纯碱晶体与稀盐酸 D.块状纯碱晶体与稀硫酸.
【答案】分析:(1)①根据表中数据比较分析.
②制取二氧化碳不需要加热,乙装置不如丙装置便于控制反应的发生分析.
③根据二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊试液变红色;盐酸能挥发出少量的氯化氢气体分析
④根据碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳分析.
⑤根据碳酸钠和稀盐酸反应速度太快不易控制所有可减小稀盐酸的浓度降低反应速度分析.
(2)根据有盐酸反应得到的二氧化碳不纯,稀硫酸和石灰石反应不能进行到底;块状纯碱晶体与稀硫酸反应生成的二氧化碳纯净且反应速度适中不会太快分析.
解答:解:(1))①根据表中数据比较,纯碱晶体与盐酸反应的速度快,故答案:纯碱晶体与盐酸反应的速度快.
②制取二氧化碳不需要加热,乙装置不如丙装置便于控制反应的发生,故答案:丙.
③二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊试液变红色;盐酸能挥发出少量的氯化氢气体,故答案:试液变红;也可能是盐酸挥发出的氯化氢气体使石蕊试液变红.
④碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,故答案:CaCO3+2HCl═CaCl2+H2O+CO2↑.
⑤碳酸钠和稀盐酸反应速度太快不易控制所有可减小稀盐酸的浓度降低反应速度,故答案:变小.
(2)有盐酸反应得到的二氧化碳不纯,稀硫酸和石灰石反应不能进行到底;块状纯碱晶体与稀硫酸反应生成的二氧化碳纯净且反应速度适中不会太快,故答案:D; 有盐酸反应得到的二氧化碳不纯,稀硫酸和石灰石反应不能进行到底.
点评:本题考查了实验室制取二氧化碳的药品选择问题,从所学的实验室制取二氧化碳和稀盐酸的相关知识入手分析.
②制取二氧化碳不需要加热,乙装置不如丙装置便于控制反应的发生分析.
③根据二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊试液变红色;盐酸能挥发出少量的氯化氢气体分析
④根据碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳分析.
⑤根据碳酸钠和稀盐酸反应速度太快不易控制所有可减小稀盐酸的浓度降低反应速度分析.
(2)根据有盐酸反应得到的二氧化碳不纯,稀硫酸和石灰石反应不能进行到底;块状纯碱晶体与稀硫酸反应生成的二氧化碳纯净且反应速度适中不会太快分析.
解答:解:(1))①根据表中数据比较,纯碱晶体与盐酸反应的速度快,故答案:纯碱晶体与盐酸反应的速度快.
②制取二氧化碳不需要加热,乙装置不如丙装置便于控制反应的发生,故答案:丙.
③二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊试液变红色;盐酸能挥发出少量的氯化氢气体,故答案:试液变红;也可能是盐酸挥发出的氯化氢气体使石蕊试液变红.
④碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,故答案:CaCO3+2HCl═CaCl2+H2O+CO2↑.
⑤碳酸钠和稀盐酸反应速度太快不易控制所有可减小稀盐酸的浓度降低反应速度,故答案:变小.
(2)有盐酸反应得到的二氧化碳不纯,稀硫酸和石灰石反应不能进行到底;块状纯碱晶体与稀硫酸反应生成的二氧化碳纯净且反应速度适中不会太快,故答案:D; 有盐酸反应得到的二氧化碳不纯,稀硫酸和石灰石反应不能进行到底.
点评:本题考查了实验室制取二氧化碳的药品选择问题,从所学的实验室制取二氧化碳和稀盐酸的相关知识入手分析.

练习册系列答案
相关题目
某学习小组对用碳酸盐可以制取CO2进行如下研究:
(1)向盛有等质量块状纯碱固体和块状碳酸钙固体的两装置中同时分别加入足量的相同质量相同浓度的稀盐酸,测得生成的CO2质量与时间关系如下表.
①从表中数据获得信息______.
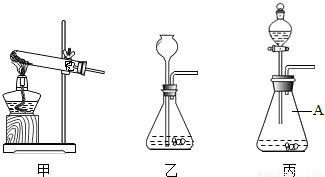
②如图是一组实验装置,该实验除用到电子秤外,还需用图中______装置(填所选装置编号).
③实验中小红同学用沾有紫色石蕊试液的玻璃棒放在所选装 置的导管口检验生成的气体,观察到的现象为______,由此她认为产生的气体为CO2.小军同学认为小红同学的验证不严密,理由是______.
④请写出块状碳酸钙固体与稀盐酸反应方程式为______.
⑤由上表数据可知,若用块状纯碱晶体代替块状石灰石制取CO2,为保证实验时间接近,所用稀盐酸质量分数需______(选填“变大”、“变小”或“不变”).
(2)若需制取较纯净的CO2,则最好选择下列哪组药品?______,因为:______.
A.块状石灰石与稀盐酸 B.块状石灰石与稀硫酸
C.块状纯碱晶体与稀盐酸 D.块状纯碱晶体与稀硫酸
(3)丙图中标号仪器A的名称为______,用装置甲制取氧气的化学反应方程式为______ K2MnO4+MnO2+O2↑

(1)向盛有等质量块状纯碱固体和块状碳酸钙固体的两装置中同时分别加入足量的相同质量相同浓度的稀盐酸,测得生成的CO2质量与时间关系如下表.
| 生成CO2质量/g | 2 | 4 | 6 | 8 | 12 | |
| 时间/s | 块状碳酸钙固体 | 10 | 25 | 40 | 60 | 85 |
| 块状纯碱晶体 | 4 | 9 | 15 | 25 | 40 | |
②如图是一组实验装置,该实验除用到电子秤外,还需用图中______装置(填所选装置编号).
③实验中小红同学用沾有紫色石蕊试液的玻璃棒放在所选装 置的导管口检验生成的气体,观察到的现象为______,由此她认为产生的气体为CO2.小军同学认为小红同学的验证不严密,理由是______.
④请写出块状碳酸钙固体与稀盐酸反应方程式为______.
⑤由上表数据可知,若用块状纯碱晶体代替块状石灰石制取CO2,为保证实验时间接近,所用稀盐酸质量分数需______(选填“变大”、“变小”或“不变”).
(2)若需制取较纯净的CO2,则最好选择下列哪组药品?______,因为:______.
A.块状石灰石与稀盐酸 B.块状石灰石与稀硫酸
C.块状纯碱晶体与稀盐酸 D.块状纯碱晶体与稀硫酸
(3)丙图中标号仪器A的名称为______,用装置甲制取氧气的化学反应方程式为______ K2MnO4+MnO2+O2↑
某学习小组对用碳酸盐可以制取CO2进行如下研究:

(1)向盛有等质量块状纯碱固体和块状碳酸钙固体的两装置中同时分别加入足量的相同质量相同浓度的稀盐酸,测得生成的CO2质量与时间关系如下表.
①从表中数据获得信息______.
②如图是一组实验装置,该实验除用到电子秤外,还需用图中______装置(填所选装置编号).
③实验中小红同学用沾有紫色石蕊试液的玻璃棒放在所选装 置的导管口检验生成的气体,观察到的现象为______,由此她认为产生的气体为CO2.小军同学认为小红同学的验证不严密,理由是______.
④请写出块状碳酸钙固体与稀盐酸反应方程式为______.
⑤由上表数据可知,若用块状纯碱晶体代替块状石灰石制取CO2,为保证实验时间接近,所用稀盐酸质量分数需______(选填“变大”、“变小”或“不变”).
(2)若需制取较纯净的CO2,则最好选择下列哪组药品?______,因为:______.
A.块状石灰石与稀盐酸 B.块状石灰石与稀硫酸
C.块状纯碱晶体与稀盐酸 D.块状纯碱晶体与稀硫酸
(3)丙图中标号仪器A的名称为______,用装置甲制取氧气的化学反应方程式为______ K2MnO4+MnO2+O2↑

(1)向盛有等质量块状纯碱固体和块状碳酸钙固体的两装置中同时分别加入足量的相同质量相同浓度的稀盐酸,测得生成的CO2质量与时间关系如下表.
| 生成CO2质量/g | 2 | 4 | 6 | 8 | 12 | |
| 时间/s | 块状碳酸钙固体 | 10 | 25 | 40 | 60 | 85 |
| 块状纯碱晶体 | 4 | 9 | 15 | 25 | 40 | |
②如图是一组实验装置,该实验除用到电子秤外,还需用图中______装置(填所选装置编号).
③实验中小红同学用沾有紫色石蕊试液的玻璃棒放在所选装 置的导管口检验生成的气体,观察到的现象为______,由此她认为产生的气体为CO2.小军同学认为小红同学的验证不严密,理由是______.
④请写出块状碳酸钙固体与稀盐酸反应方程式为______.
⑤由上表数据可知,若用块状纯碱晶体代替块状石灰石制取CO2,为保证实验时间接近,所用稀盐酸质量分数需______(选填“变大”、“变小”或“不变”).
(2)若需制取较纯净的CO2,则最好选择下列哪组药品?______,因为:______.
A.块状石灰石与稀盐酸 B.块状石灰石与稀硫酸
C.块状纯碱晶体与稀盐酸 D.块状纯碱晶体与稀硫酸
(3)丙图中标号仪器A的名称为______,用装置甲制取氧气的化学反应方程式为______ K2MnO4+MnO2+O2↑

 某学习小组对用碳酸盐可以制取CO2进行如下研究:
某学习小组对用碳酸盐可以制取CO2进行如下研究: