题目内容
【题目】Ⅰ是 80℃含有 120g 水的 NH4Cl 溶液,经过如下操作,得到 10g NH4Cl 固体。
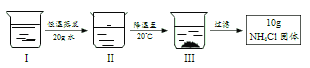
下列说法正确的是
A.溶液Ⅰ中溶质的质量可能大于 65.6g
B.溶液Ⅱ中溶质与溶剂的质量比为 65.6:100
C.溶液Ⅲ中溶质的质量分数约为 37.2%
D.溶液Ⅱ→Ⅲ的过程中,开始析出固体的温度必定在 40℃~60℃之间
【答案】D
【解析】
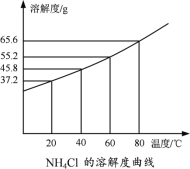
根据固体的溶解度表可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
A、I中溶剂的质量为120g,恒温蒸发20g水后剩余100g水,这时II中并没有晶体析出说明I是不饱和溶液,II降温至20℃后,这时III中有晶体析出,证明III是饱和溶液,这时根据溶解度曲线得知,III中溶质的质量为37.2g,加上析出的10gNH4Cl,一共是47.2g,故I中的溶质质量不可能大于47.2g,所以A错误,不符合题意。
B、根据上面分析II中的溶质质量为47.2g,溶剂的质量为100g,溶质与溶剂的质量比为47.2:100,故B错误,不符合题意。
C、根据上面分析III中是饱和溶液,溶质质量分数=![]() ≈27.1%。故C错误,不符合题意。
≈27.1%。故C错误,不符合题意。
D、II中无晶体析出,故里面NH4Cl的质量为47.2g,故开始析出固体的温度必定在 40℃~60℃之间,D正确,符合题意。
故选:D。

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目