题目内容
【题目】完成下列变化的化学方程式,并按要求填空。
(1) 镁粉在空气中燃烧;____;常用镁粉制_____。
(2)加热铜绿:________;其基本反应类型是:_____。
(3)加热碳酸氢铵固体:________;保存方法是______。
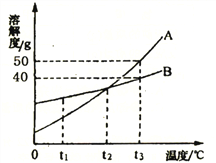
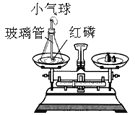
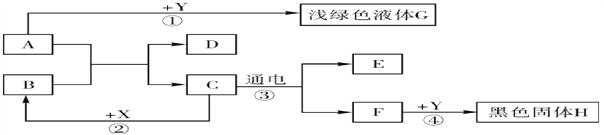
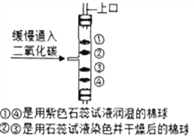
(4)实验室制取二氧化碳气体:__________________;如右图:将干燥CO2缓慢通入竖直放置的玻璃管中,能观察到第_______(填序号)号棉球先变色。
【答案】 2Mg+O2![]() 2MgO 常用镁粉制照明灯 Cu2(OH)2CO3
2MgO 常用镁粉制照明灯 Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑ 分解反应 NH4HCO3
2CuO+H2O+CO2↑ 分解反应 NH4HCO3![]() NH3↑+ CO2↑+ H2O 密闭放在阴凉处 CaCO3+ 2HCl=CaCl2+ H2O + CO2↑ ②
NH3↑+ CO2↑+ H2O 密闭放在阴凉处 CaCO3+ 2HCl=CaCl2+ H2O + CO2↑ ②
【解析】书写化学方程式的步骤一般有四步:1.根据实验事实,在式子的左、右两边分别写出反应物和生成物的化学式,并在式子的左、右两边之间画一条短线;当反应物或生成物有多种时,中间用加号(即“+”)连接起来。2.配平化学方程式,并检查后,将刚才画的短线改写成等号(表示式子左、右两边每一种元素原子的总数相等)。3.标明化学反应发生的条件(因为化学反应只有在一定的条件下才能发生);如点燃、加热(常用“△”号表示)、催化剂、通电等。并且,一般都写在等号的上面,若有两个条件,等号上面写一个下面写一个。4.注明生成物中气体或固体的状态符号(即“↑”、“↓”);一般标注在气体或固体生成物的化学式的右边.但是,如果反应物和生成物中都有气体或固体时,其状态符号就不用标注了。(1) 镁粉在空气中燃烧生成氧化镁,反应的化学方程式为:2Mg+O2![]() 2MgO;常用镁粉制照明灯;(2)铜绿是碱式碳酸铜的俗称,碱式碳酸铜在加热条件下生成氧化铜、水、二氧化碳,反应的化学方程式为:Cu2(OH)2CO3
2MgO;常用镁粉制照明灯;(2)铜绿是碱式碳酸铜的俗称,碱式碳酸铜在加热条件下生成氧化铜、水、二氧化碳,反应的化学方程式为:Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑;该反应符合“一变多”的特征,属于分解反应; (3)加热碳酸氢铵固体生成氨气、水,反应的化学方程式为: NH4HCO3
2CuO+H2O+CO2↑;该反应符合“一变多”的特征,属于分解反应; (3)加热碳酸氢铵固体生成氨气、水,反应的化学方程式为: NH4HCO3![]() NH3↑+ CO2↑+ H2O;保存方法是密闭放在阴凉处;(4)实验室制取二氧化碳气体,是碳酸钙和盐酸生成氯化钙、二氧化碳、水,反应的化学方程式为: CaCO3 + 2HCl == CaCl2 + H2O + CO2↑;二氧化碳的密度比空气大,能与水反应生成碳酸,能使紫色石蕊试液变红,将干燥CO2缓慢通入竖直放置的玻璃管中,能观察到第②号棉球先变色。
NH3↑+ CO2↑+ H2O;保存方法是密闭放在阴凉处;(4)实验室制取二氧化碳气体,是碳酸钙和盐酸生成氯化钙、二氧化碳、水,反应的化学方程式为: CaCO3 + 2HCl == CaCl2 + H2O + CO2↑;二氧化碳的密度比空气大,能与水反应生成碳酸,能使紫色石蕊试液变红,将干燥CO2缓慢通入竖直放置的玻璃管中,能观察到第②号棉球先变色。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】为了探究化学反应前后各物质的总质量是否发生改变,甲、乙、丙三组同学分别进行了下列实验,请根据图示回答问题。
[实验探究]甲、乙、丙三组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | 丙组 | |
实验装置 |
|
|
|
⑴甲组同学的实验现象是红磷燃烧,产生大量_______;小气球先膨胀,冷却后变得更瘪;反应后冷却到室温称量,天平的指针_______(填:“向右”、“向左”或“不”)偏转。在该实验中,玻璃管上系一个小气球的目的是________。该反应的化学方程式为_______。
⑵乙组同学的实验现象是铁钉表面有红色固体析出,溶液变为________色,反应前、后天平保持平衡。该反应的化学方程式为________。
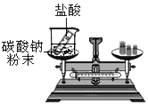
⑶丙组同学的实验现象是反应剧烈,产生大量气泡,反应后天平不保持平衡。
[实验结论]化学反应前后各物质的总质量不发生改变。
[实验反思]在探究化学反应前后各物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在________装置中进行。