题目内容
【题目】将CO通入盛有16gFe2O3固体的试管中,高温下反应,并将产生的气体用足量的澄清石灰水充分吸收。反应一段时间后,停止加热,继续通入CO至试管冷却,此时试管内残留固体质量为14.4g。则下列说法不正确的是
A.反应后剩余固体中铁元素的质量为11.2gB.通入CO的质量一定大于2.8g
C.理论上确定,试管中残留固体可以是FeOD.反应后澄清石灰水增重1.6g
【答案】D
【解析】
A、 据质量守恒定律可知,反应前后物质的元素的种类、质量不变,反应后剩余固体中铁元素的质量等于16g Fe2O3中铁元素的质量=16g ×![]() =11.2g,选项正确;
=11.2g,选项正确;
B、 由反应原理可知,固体减少的质量为参加反应的氧化铁中氧元素的质量,16g-14.4g=1.6g, 氧化铁中的氧元素和一氧化碳结合生成二氧化碳,设参加反应的一氧化碳的质量为x,
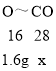
![]() x=2.8g,但是反应前要先通一段时间一氧化碳,排尽装置内的空气,防止加热时发生爆炸,通入CO的质量一定大于2.8g,选项正确;
x=2.8g,但是反应前要先通一段时间一氧化碳,排尽装置内的空气,防止加热时发生爆炸,通入CO的质量一定大于2.8g,选项正确;
C、试管中残留固体中铁元素的质量为11.2g,则氧元素的质量=14.4g-11.2g=3.2g,则试管中残留固体中铁原子与氧原子的质量比=![]() ,理论上确定,试管中残留固体可以是FeO,选项正确;
,理论上确定,试管中残留固体可以是FeO,选项正确;
D、 据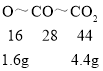 ,反应后澄清石灰水增重4.4g,选项错误。故选D。
,反应后澄清石灰水增重4.4g,选项错误。故选D。

练习册系列答案
相关题目