题目内容
【题目】“双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气 等。化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如下图所示。同学们 对这包久置的“双吸剂”固体 样品很好奇,设计实验进行探究。

(提出问题)久置“双吸剂”固体的成分是什么?
(查阅资料)
①铁与氯化铁溶液在常温下反应生成氯化亚铁:Fe + 2FeCl3 =3FeCl2;
②碱性的 Na2CO3 溶液可以与中性的 CaCl2 溶液发生复分解反应。
(作出猜想)久置固体中可能含有 Fe、Fe2O3、CaO、Ca(OH)2 和 CaCO3。
(定性研究)小明取少量样品放入试管中,加入一定量的稀盐酸,发现,试管中固体质量逐渐减少,生成一种 能使澄清石灰水变浑浊的气体,得到浅绿色溶液,他初步判断:样品中一定含有_______,一定不含 Fe2O3
(实验质疑)小组同学谈论认为上述实验并不能得出一定不含Fe2O3的结论,理由是_______,(用化学方程式表示)
为进一步确定这包久置的“双吸剂”固体的成分进行如下定量实验。
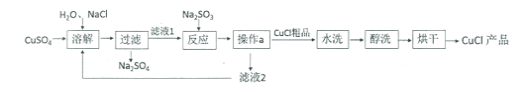
(定量研究)取 3g 样品研碎,并用磁铁充分吸引后,得到剩余固体2.6g,按照下图流程进行实验,请回答相关问题:
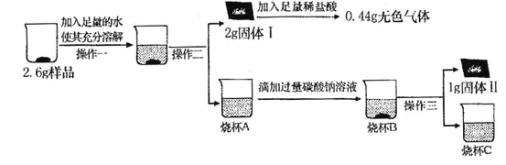
(1)操作二、操作三名称是_______。
(2)固体 I 的成分是_______。(填物质化学式,下同);
(3)写出生成固体Ⅱ的化学方程式_______。
(实验反思)结合上面的实验,下列说法正确的是_______(填字母序号)
A.对物质成分的研究有时需要定性和定量相结合
B.在原样品中加入足量盐酸有4个反应发生
C.定量研究烧杯C中的溶质为NaOH和Na2CO3
【答案】碳酸钙和铁 Fe2O3+6HCl═2FeCl3+3H2O;Fe+2FeCl3=3FeCl2 过滤 CaCO3、Fe2O3 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH AC
【解析】
{定性研究}生成一种能使澄清石灰水变浑浊的气体,该气体是二氧化碳,样品中一定含有碳酸钙,铁与盐酸和氯化铁反应均能生成氯化亚铁,氯化亚铁溶于水呈绿色,则样品一定含铁,故填碳酸钙和铁。
{实验质疑}
小组同学谈论认为上述实验并不能得出一定不含Fe2O3的结论,理由是氧化铁和稀盐酸反应生成氯化铁,氯化铁和铁反应生成氯化亚铁,溶液也是浅绿色,故反应的化学方程式写为:Fe2O3+6HCl═2FeCl3+3H2O,Fe+2FeCl3=3FeCl2。
{定量研究}
(1)操作二、操作三均将固体与液体进行了分离,操作名称是过滤,故填过滤。
(2)铁质量为:3g-2.6g=0.4g,加入足量稀盐酸得到0.44g二氧化碳,说明碳酸钙质量是1g,则氧化铁质量为:2g-1g=1g,则固体I的成分是CaCO3、Fe2O3,故填CaCO3、Fe2O3。
(3)固体Ⅱ是碳酸钠和氢氧化钙反应生成的碳酸钙,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,故反应的化学方程式写为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。
{实验反思}
A.对物质成分的研究有时需要定性和定量相结合,选项正确;
B.碳酸钠和氢氧化钙反应生成1g碳酸钙时,消耗氢氧化钙质量是0.74g,则氧化钙或氢氧化钙或氧化钙和氢氧化钙的质量是:2.6g-2g=0.6g,如果0.6g全部是氢氧化钙时,生成碳酸钙质量小于1g,如果0.6g全部是氧化钙时,生成碳酸钙质量大于1g,因此0.6g是氧化钙和氢氧化钙的混合物,即样品中含有铁、氧化铁、氧化钙、氢氧化钙和碳酸钙,在原样品中加入足量盐酸时,铁、氧化铁、氧化钙、氢氧化钙和碳酸钙都能够和稀盐酸反应,因此有5个反应发生,选项错误;
C.定量研究烧杯C中的溶质为过量的碳酸钠和反应生成的氢氧化钠,选项正确,故填AC。

 名校课堂系列答案
名校课堂系列答案