��Ŀ����
����Ŀ���Ȼ���ͭ(CuCl)�㷺Ӧ����ұ�𡢵�ơ�ҽҩ����ҵ����֪CuCl������ˮ���Ҵ����ڳ�ʪ�������ױ��ʡ�CuCl���Ʊ��������£�
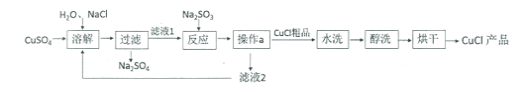
��1������Һ1���г���Na+��SO42-�⣬�����ڽ϶��������______��_______��д���ӷ��ţ�
��2������Ӧ���з����Ļ�ѧ�仯��2CuCl2+Na2SO3=2CuCl��+2NaCl+SO3��������SO3Ѹ����ˮ��������һ���ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ___________��
��3��������a����������__________���������п���ѭ�����õ����ʣ�ˮ���⣩��__________����д��ѧʽ��
��4��������ˮϴ����ԭ����__________������ϴ����Ŀ����______________��
���𰸡�Cu2+ Cl- SO3+H2O�TH2SO4 ���� NaCl �ܹ���ȥ���������� ���Գ�ȥˮ����ֹ�ں���������CuCl����
��������
��1������ͭ���Ȼ���һ���ܽ⣬�������ʲ���Ӧ����������Һ1���г���Na+��SO42-�⣬�����ڽ϶�������� Cu2+��Cl-��
���Cu2+��Cl-��
��2��������SO3Ѹ����ˮ�����������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ��SO3+H2O�TH2SO4��
���SO3+H2O�TH2SO4��
��3��������a���������ǹ��ˣ�ͨ�����˰�Һ�������룻
�������п���ѭ�����õ����ʣ�ˮ���⣩��NaCl��
������ˣ�NaCl��
��4��������ˮϴ����ԭ�����ܹ���ȥ���������ʣ�����ϴ����Ŀ���ǿ��Գ�ȥˮ����ֹ�ں���������CuCl���ʡ�
����ܹ���ȥ���������ʣ����Գ�ȥˮ����ֹ�ں���������CuCl���ʡ�

 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�