题目内容
【题目】根据实验内容填空:
(1)为了验证金属的活动性,同学们将洁净的铁钉放入硫酸铜溶液中,观察到铁钉表面变为红色,反应的化学方程式为 .
(2)细心的同学发现,铁钉表面同时含有气泡冒出,就此气泡成分,同学们在老师指导下进行了如下探究:
【提出猜想】
同学 | A | B | C | D |
对气泡成分的猜想 | 氧气 | 二氧化硫 | 二氧化碳 | 氢气 |
同学们一致认为C同学的猜想是不合理的,理由是 .
(3)【查阅资料】二氧化硫具有漂白性,会使品红溶液褪色.
【进行实验】利用如图所示的装置分别进行实验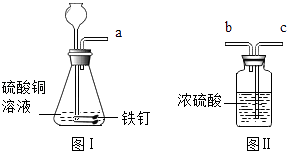
①反应一段时间后,A同学将带火星的木条放在a处,观察到 , 则她的猜想错误.
②B同学将产生的气体通入品红溶液中,观察到 , 则她的猜想也错误.
③D同学将图Ⅰ中的a端导管与图Ⅱ中的端导管相连,目的是对其他进行 . 反应一段时间后,点燃从图Ⅱ另一端导管出来的气体,通过对现象的分析,得出他的猜想正确.
(4)【得出结论】铁与硫酸铜溶液反应时伴随产生了氢气.
【讨论反思】这几位同学的实验方案存在安全隐患,理由是 , 改进的方法是 .
(5)【继续追问】铁与硫酸铜溶液反应为什么会伴随产生氢气?
【查阅资料】有些盐在水溶液中会发生水解反应,使盐溶液不一定呈中性.
【再次猜想】硫酸铜溶液可能显性.
(6)【验证方案】
操作 | 现象 | 结论 |
[再次猜想]是正确的. |
【反思与评价】同学们做完以上实验很有成就感,体验到探究的快乐,并感慨“科学探究无止境”!
【答案】
(1)Fe+CuSO4═FeSO4+Cu
(2)根据质量守恒定律,化学反应前后元素种类不变,反应物中没有碳元素所以生成物中一定没有二氧化碳
(3)带火星的木条没有复燃,品红溶液不褪色,c,干燥
(4)该实验中氢气属于可燃性气体,不纯点燃可能会发生爆炸,先将从a处的气体通入图Ⅱ一段时间后再点燃铁和先将从a处的气体通入图Ⅱ一段时间后再点燃
(5)酸
(6)向硫酸铜溶液中滴加石蕊试液,溶液变红
【解析】解:在金属活动性表中铁排在铜前面,能置换出硫酸铜溶液中的铜,铁和硫酸铜溶液反应生成铜和硫酸亚铁;化学方程式Fe+CuSO4═FeSO4+Cu;
【提出猜想】根据质量守恒定律,化学反应前后元素种类不变,反应物中没有碳元素所以生成物中一定没有二氧化碳;故填:根据质量守恒定律,化学反应前后元素种类不变,反应物中没有碳元素所以生成物中一定没有二氧化碳;
【进行实验】①氧气具有助燃性,能使带火星的木条复燃,证明不是氧气,则带火星的木条没有复燃;故填:带火星的木条没有复燃;②二氧化硫具有漂白性,会使品红溶液褪色,证明不是二氧化硫,则品红溶液不褪色;故填:品红溶液不褪色;③氢气属于可燃性气体,能燃烧,但从图Ⅰ中制得的氢气会带有水蒸气,需要干燥,干燥气体長进短出,故填:c;干燥;
【讨论反思】氢气属于可燃性气体,不纯点燃可能会发生爆炸,故填:该实验中氢气属于可燃性气体,不纯点燃可能会发生爆炸;先将从a处的气体通入图Ⅱ一段时间后再点燃铁和先将从a处的气体通入图Ⅱ一段时间后再点燃;
【再次猜想】铁与酸反应生成氢气和硫酸亚铁,发生反应的化学方程式为Fe+H2SO4═FeSO4+H2↑;而铁和硫酸铜溶液反应生成了氢气,所以溶液呈酸性;故填:酸;
【验证方案】要验证溶液呈酸性,在溶液中滴加石蕊试液,能使紫色石蕊试液变红,证明溶液显酸性,故填:向硫酸铜溶液中滴加石蕊试液;溶液变红;
故答案为:
Fe+CuSO4═FeSO4+Cu;
【提出猜想】根据质量守恒定律,化学反应前后元素种类不变,反应物中没有碳元素所以生成物中一定没有二氧化碳;
【进行实验】(1)带火星的木条没有复燃;(2)品红溶液不褪色;(3)c;干燥;
【讨论反思】该实验中氢气属于可燃性气体,不纯点燃可能会发生爆炸;先将从a处的气体通入图Ⅱ一段时间后再点燃;
【再次猜想】酸;
【验证方案】向硫酸铜溶液中滴加石蕊试液;溶液变红.
根据氧气的检验方法分析,检验氧气用带火星的木条,若复燃,则证明是氧气;根据金属活动性顺序中,排在前面的金属能与排在后面的金属的盐溶液发生反应分析;根据质量守恒定律反应前后元素种类不变分析。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案