题目内容
(2013?怀化)某化学兴趣小组为了测定某工厂废水池中硫酸的含量,取100g废水于烧杯中,加入80g质量分数为10%的氢氧化钠溶液,充分搅拌,反应恰好完全.试计算:(温馨提示:假定废水中不含固态物质,其他成分均不与氢氧化钠反应)
(1)废水中硫酸的质量分数.
(2)为消除该工业废水对环境的影响并变废为宝,该工厂对该废水进行了相应的处理.其中一种措施是将废水引入某特殊反应池中加入足量废铁屑制取副产品硫酸亚铁(FeSO4)和氢气,若该厂每天用这种方法处理100吨废水,试通过计算说明该工厂每天理论上能生产多少吨硫酸亚铁.
(1)废水中硫酸的质量分数.
(2)为消除该工业废水对环境的影响并变废为宝,该工厂对该废水进行了相应的处理.其中一种措施是将废水引入某特殊反应池中加入足量废铁屑制取副产品硫酸亚铁(FeSO4)和氢气,若该厂每天用这种方法处理100吨废水,试通过计算说明该工厂每天理论上能生产多少吨硫酸亚铁.
分析:(1)依据硫酸和氢氧化钠反应的方程式结合氢氧化钠的质量可以计算出反应的硫酸的质量即可解答本题;
(2)依据反应的硫酸的质量利用铁和硫酸反应的方程式即可计算出反应生成硫酸亚铁的质量;
(2)依据反应的硫酸的质量利用铁和硫酸反应的方程式即可计算出反应生成硫酸亚铁的质量;
解答:解:(1)设参与反应的H2SO4质量为x,
H2SO4+2NaOH=2H2O+Na2SO4
98 80
x 80g×10%
=
解之得:x=9.8g,
废水中硫酸的质量分数为:
×100%=9.8%.
(2)可生产硫酸亚铁的质量为x
Fe+H2SO4═FeSO4+H2↑
98 152
100t×9.8% x
=
x=15.2t
答:(1)废水中硫酸的质量分数为9.8%;(2)每天理论上能生产15.2t硫酸亚铁;
H2SO4+2NaOH=2H2O+Na2SO4
98 80
x 80g×10%
| 98 |
| x |
| 80 |
| 80g×10% |
解之得:x=9.8g,
废水中硫酸的质量分数为:
| 9.8g |
| 100g |
(2)可生产硫酸亚铁的质量为x
Fe+H2SO4═FeSO4+H2↑
98 152
100t×9.8% x
| 98 |
| 100t×9.8% |
| 152 |
| x |
x=15.2t
答:(1)废水中硫酸的质量分数为9.8%;(2)每天理论上能生产15.2t硫酸亚铁;
点评:本题主要考查学生运用化学方程式进行计算的能力,数量掌握相关的溶液及化学方程式基本计算是解题的关键所在;

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
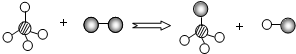 (2013?怀化)某反应的微观示意图(一种小球代表一种元素的原子),则下列说法中正确的是( )
(2013?怀化)某反应的微观示意图(一种小球代表一种元素的原子),则下列说法中正确的是( )