题目内容
质量分数不同的硫酸溶液其密度不相同,对照表如下:
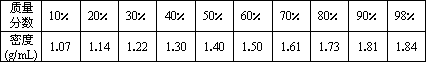
将10 mL 98%浓硫酸中加水稀释至100 ml,取10 mL该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
(1)10 mL 98%的浓硫酸中含________g H2SO4.
(2)列式计算消耗金属锌的质量.
(3)分析表中数据,可以归纳出硫酸溶液的质量分数与密度的关系是________.10 mL水和10 mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数应该在________至________之间.
答案:(1)根据对照表,98%的浓硫酸的密度为1.84g/mL,10mL98%浓硫酸中溶质硫酸的质量=10mL×1.84g/mL×98%≈18.0g
故答案为:18.0;
(2)所取10mL稀硫酸中硫酸的质量=18g× =1.8g,设10mL稀硫酸与锌完全反应消耗锌的质量为x
=1.8g,设10mL稀硫酸与锌完全反应消耗锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 98
x 1.8g
 x≈1.2g
x≈1.2g
答:消耗金属锌的质量约为1.2g;
(3)从对照表可以得到:硫酸溶液质量分数从10%至98%不断增大,硫酸溶液的密度也在不断增大;
故答案为:质量分数越大密度越大;
假设硫酸溶液的密度为ρ,
10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数= ×100%=
×100%= ×b%
×b%
①当ρ=1.07g/ml时,混合后溶液的质量分数= ×b%≈0.52b%;
×b%≈0.52b%;
②当ρ=1.84g/ml时,混合后溶液的质量分数= ×b%≈0.65b%.
×b%≈0.65b%.
所以该在0.52b%~0.65b%;
故答案为:0.52b%;0.65b%.
故答案为:18.0;
(2)所取10mL稀硫酸中硫酸的质量=18g×
 =1.8g,设10mL稀硫酸与锌完全反应消耗锌的质量为x
=1.8g,设10mL稀硫酸与锌完全反应消耗锌的质量为xZn+H2SO4=ZnSO4+H2↑
65 98
x 1.8g
 x≈1.2g
x≈1.2g答:消耗金属锌的质量约为1.2g;
(3)从对照表可以得到:硫酸溶液质量分数从10%至98%不断增大,硫酸溶液的密度也在不断增大;
故答案为:质量分数越大密度越大;
假设硫酸溶液的密度为ρ,
10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数=
 ×100%=
×100%= ×b%
×b%①当ρ=1.07g/ml时,混合后溶液的质量分数=
 ×b%≈0.52b%;
×b%≈0.52b%;②当ρ=1.84g/ml时,混合后溶液的质量分数=
 ×b%≈0.65b%.
×b%≈0.65b%.所以该在0.52b%~0.65b%;
故答案为:0.52b%;0.65b%.

练习册系列答案
相关题目
下表列出了KNO3在不同温度下的溶解度.
(1)由上表可推出KNO3溶解度曲线的变化规律是KNO3溶解度随温度升高而 .
(2)在20℃时,把40 g KNO3放入小烧杯中,然后再加入100 g水不断搅拌,形成溶液的质量为 g;该溶液是 (填“饱和”或“不饱和”)溶液.
(3)如图所示,把上述(2)中的小烧杯放到盛水的大烧杯中.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,能够使小烧杯中的KNO3溶液溶质的质量分数增大的是 (填序号).①浓硫酸,②硝酸铵,③氢氧化钠,④冰
(4)60℃时,把55g KNO3溶于水配成饱和溶液,最多可配得饱和溶液的质量为 g.

| 温度/℃ | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
(2)在20℃时,把40 g KNO3放入小烧杯中,然后再加入100 g水不断搅拌,形成溶液的质量为 g;该溶液是 (填“饱和”或“不饱和”)溶液.
(3)如图所示,把上述(2)中的小烧杯放到盛水的大烧杯中.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,能够使小烧杯中的KNO3溶液溶质的质量分数增大的是 (填序号).①浓硫酸,②硝酸铵,③氢氧化钠,④冰
(4)60℃时,把55g KNO3溶于水配成饱和溶液,最多可配得饱和溶液的质量为 g.

(2009?梅州)下表列出了KNO3在不同温度下的溶解度.
(1)由上表可推出KNO3溶解度曲线的变化规律是KNO3溶解度随温度升高而.
(2)在20℃时,把40 g KNO3放入小烧杯中,然后再加入100 g水不断搅拌,形成溶液的质量为g;该溶液是(填“饱和”或“不饱和”)溶液.
(3)如图所示,把上述(2)中的小烧杯放到盛水的大烧杯中.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,能够使小烧杯中的KNO3溶液溶质的质量分数增大的是(填序号).①浓硫酸,②硝酸铵,③氢氧化钠,④冰
(4)60℃时,把55g KNO3溶于水配成饱和溶液,最多可配得饱和溶液的质量为g.

| 温度/℃ | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
(2)在20℃时,把40 g KNO3放入小烧杯中,然后再加入100 g水不断搅拌,形成溶液的质量为g;该溶液是(填“饱和”或“不饱和”)溶液.
(3)如图所示,把上述(2)中的小烧杯放到盛水的大烧杯中.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,能够使小烧杯中的KNO3溶液溶质的质量分数增大的是(填序号).①浓硫酸,②硝酸铵,③氢氧化钠,④冰
(4)60℃时,把55g KNO3溶于水配成饱和溶液,最多可配得饱和溶液的质量为g.

20.(2009?梅州)下表列出了KNO3在不同温度下的溶解度.
(1)由上表可推出KNO3溶解度曲线的变化规律是KNO3溶解度随温度升高而.
(2)在20℃时,把40 g KNO3放入小烧杯中,然后再加入100 g水不断搅拌,形成溶液的质量为g;该溶液是(填“饱和”或“不饱和”)溶液.
(3)如图所示,把上述(2)中的小烧杯放到盛水的大烧杯中.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,能够使小烧杯中的KNO3溶液溶质的质量分数增大的是(填序号).①浓硫酸,②硝酸铵,③氢氧化钠,④冰
(4)60℃时,把55g KNO3溶于水配成饱和溶液,最多可配得饱和溶液的质量为g.

| 温度/℃ | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
(2)在20℃时,把40 g KNO3放入小烧杯中,然后再加入100 g水不断搅拌,形成溶液的质量为g;该溶液是(填“饱和”或“不饱和”)溶液.
(3)如图所示,把上述(2)中的小烧杯放到盛水的大烧杯中.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,能够使小烧杯中的KNO3溶液溶质的质量分数增大的是(填序号).①浓硫酸,②硝酸铵,③氢氧化钠,④冰
(4)60℃时,把55g KNO3溶于水配成饱和溶液,最多可配得饱和溶液的质量为g.

19.(2009?梅州)下表列出了KNO3在不同温度下的溶解度.
(1)由上表可推出KNO3溶解度曲线的变化规律是KNO3溶解度随温度升高而.
(2)在20℃时,把40 g KNO3放入小烧杯中,然后再加入100 g水不断搅拌,形成溶液的质量为g;该溶液是(填“饱和”或“不饱和”)溶液.
(3)如图所示,把上述(2)中的小烧杯放到盛水的大烧杯中.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,能够使小烧杯中的KNO3溶液溶质的质量分数增大的是(填序号).①浓硫酸,②硝酸铵,③氢氧化钠,④冰
(4)60℃时,把55g KNO3溶于水配成饱和溶液,最多可配得饱和溶液的质量为g.

| 温度/℃ | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
(2)在20℃时,把40 g KNO3放入小烧杯中,然后再加入100 g水不断搅拌,形成溶液的质量为g;该溶液是(填“饱和”或“不饱和”)溶液.
(3)如图所示,把上述(2)中的小烧杯放到盛水的大烧杯中.若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,能够使小烧杯中的KNO3溶液溶质的质量分数增大的是(填序号).①浓硫酸,②硝酸铵,③氢氧化钠,④冰
(4)60℃时,把55g KNO3溶于水配成饱和溶液,最多可配得饱和溶液的质量为g.

 19、下表列出了KNO3在不同温度下的溶解度.
19、下表列出了KNO3在不同温度下的溶解度.