题目内容
(2010?顺义区二模)实验制取二氧化碳后,产生大量含有盐酸的废液.为消除酸对水环境的污染,化学兴趣小组做了如下实验:取废液桶上层清液共60g,向其中加入溶质质量分数为21.2%的碳酸钠溶液.所得溶液pH与加入的碳酸钠溶液的质量关系如图所示.回答下列问题:

(1)处理废液中的盐酸消耗碳酸钠溶液的质量为______.
(2)废液中含氯化钙的质量分数是多少?
【答案】分析:(1)由图示可知,当碳酸钠溶液质量加到50g时,pH=7,说明此时溶液正好中和;
(2)根据碳酸钠与氯化钙反应的化学方程式,计算出废液中含氯化钙的质量,然后根据“溶质质量分数=溶质质量/溶液质量×100%”即可计算出废液中含氯化钙的质量分数,
解答:解:(1)由图示可知,当碳酸钠溶液质量加到50g时,pH=7,说明此时溶液正好完全中和;
故答案为:50g;
(2)解:设废液中含氯化钙的质量为x,
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111
(75-50)g×21.2% x
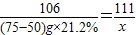
x=5.55g
废液中含氯化钙的质量分数为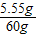 ×100%═9.25%
×100%═9.25%
点评:本题属于综合计算,主要考查学生运用所学化学知识综合分析和逻辑思维能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
(2)根据碳酸钠与氯化钙反应的化学方程式,计算出废液中含氯化钙的质量,然后根据“溶质质量分数=溶质质量/溶液质量×100%”即可计算出废液中含氯化钙的质量分数,
解答:解:(1)由图示可知,当碳酸钠溶液质量加到50g时,pH=7,说明此时溶液正好完全中和;
故答案为:50g;
(2)解:设废液中含氯化钙的质量为x,
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111
(75-50)g×21.2% x
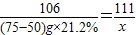
x=5.55g
废液中含氯化钙的质量分数为
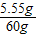 ×100%═9.25%
×100%═9.25%点评:本题属于综合计算,主要考查学生运用所学化学知识综合分析和逻辑思维能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
(2010?顺义区二模)老师从超市里买来了下列日用化工产品.
老师从中任取一种白色固体请同学们确定其成分.
[查阅资料]①氨基磺酸的化学式为NH2S03H.白色固体,常温下,氨基磺酸不吸湿,不挥发,比较稳定. 氨基磺酸的水溶液具有与盐酸、硫酸等同等的强酸性,别名固体硫酸. 氨基磺酸与清除水垢时发生如下化学反应CaCO3+2NH2SO3H=(NH2SO3)2Ca+H2O+CO2↑,氨基磺酸可以除铁锈,反应的化学方程式为______.
②石英砂:主要成分SiO2,不溶于水也不和水发生反应.
③NaHCO3的水溶液显碱性.
[设计方案]
要进一步确定粉末的成分,同学们还需要一些资料的支持,你需要查阅的资料是______.
| 商品 |  速洁粉 |  管道通 |  清垢剂 |  碱性去污粉 |
| 成分 | 碳酸钙和石英砂 | 氢氧化钠 | 氨基磺酸 | 碳酸钠或碳酸氢钠 |
[查阅资料]①氨基磺酸的化学式为NH2S03H.白色固体,常温下,氨基磺酸不吸湿,不挥发,比较稳定. 氨基磺酸的水溶液具有与盐酸、硫酸等同等的强酸性,别名固体硫酸. 氨基磺酸与清除水垢时发生如下化学反应CaCO3+2NH2SO3H=(NH2SO3)2Ca+H2O+CO2↑,氨基磺酸可以除铁锈,反应的化学方程式为______.
②石英砂:主要成分SiO2,不溶于水也不和水发生反应.
③NaHCO3的水溶液显碱性.
[设计方案]
| 实验操作 | 实验现象 | 实验结论 |
| 取固体少量与试管中,加足量水,充分振荡. | 得到无色透明溶液 | |
| ______ | ______ | 该白色固体的成分不是氨基磺酸 |
| ______ | 有气泡产生 | ______ |
