题目内容
(2010?顺义区二模)超氧化钾(KO2)可作为宇宙飞船中氧气再生剂.研究性学习小组对超氧化钾的生氧原理产生了兴趣,设计了如下实验装置: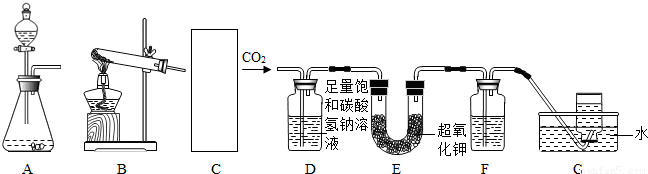
(1)C处应选择______(填A或B)作为制取CO2的发生装置,实验室制取二氧化碳的化学方程式为______.
(2)已知CO2不溶于饱和碳酸氢钠溶液,D装置的作用是______.
(3)为了除去O2中可能混有的CO2,F中可盛放过量______溶液.
(4)有同学提出,上述实验并不能证明CO2能与超氧化钾反应生成氧气,理由是______,要确定二氧化碳确实能和超氧化钾反应生成氧气,你对上述实验装置的改进方法是______.
【答案】分析:根据题意,目的是验证制取出的二氧化碳与超氧化钾反应生成氧气并验证氧气.为了得到纯净的二氧化碳和氧气,要对反应生成的气体进行净化.根据气体的性质选择适当的净化剂.
解答:解:(1)制取二氧化碳用固体和液体反应,并且不需要加热,所以应选择A装置.化学方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)为了防止二氧化碳中的氯化氢气体对后面实验的干扰,故用饱和碳酸氢钠溶液把它除去.
(3)除去O2中可能混有的CO2的方法是通过氢氧化钠溶液,二氧化碳能和氢氧化钠溶液反应,氧气不能.
(4)上述实验过程中并没有除去水,水与KO2也能反应产生氧气,因此并不能证明CO2能与超氧化钾反应生成氧气,必须在装置B和C之间增加一个干燥装置除去水蒸气然后才能证明CO2能与超氧化钾反应生成氧气.
答案:(1)A;CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)除去可能混有的氯化氢气体.
(3)NaOH.
(4)因为H2O和KO2也能反应产生O2;装置B和C之间应该增加一个干燥装置B除去水蒸气.
点评:除去一种气体中的其他杂质,要根据气体的性质进行选择,既要把杂质除去,又不能影响被除杂质的气体.
解答:解:(1)制取二氧化碳用固体和液体反应,并且不需要加热,所以应选择A装置.化学方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)为了防止二氧化碳中的氯化氢气体对后面实验的干扰,故用饱和碳酸氢钠溶液把它除去.
(3)除去O2中可能混有的CO2的方法是通过氢氧化钠溶液,二氧化碳能和氢氧化钠溶液反应,氧气不能.
(4)上述实验过程中并没有除去水,水与KO2也能反应产生氧气,因此并不能证明CO2能与超氧化钾反应生成氧气,必须在装置B和C之间增加一个干燥装置除去水蒸气然后才能证明CO2能与超氧化钾反应生成氧气.
答案:(1)A;CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)除去可能混有的氯化氢气体.
(3)NaOH.
(4)因为H2O和KO2也能反应产生O2;装置B和C之间应该增加一个干燥装置B除去水蒸气.
点评:除去一种气体中的其他杂质,要根据气体的性质进行选择,既要把杂质除去,又不能影响被除杂质的气体.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
(2010?顺义区二模)老师从超市里买来了下列日用化工产品.
老师从中任取一种白色固体请同学们确定其成分.
[查阅资料]①氨基磺酸的化学式为NH2S03H.白色固体,常温下,氨基磺酸不吸湿,不挥发,比较稳定. 氨基磺酸的水溶液具有与盐酸、硫酸等同等的强酸性,别名固体硫酸. 氨基磺酸与清除水垢时发生如下化学反应CaCO3+2NH2SO3H=(NH2SO3)2Ca+H2O+CO2↑,氨基磺酸可以除铁锈,反应的化学方程式为______.
②石英砂:主要成分SiO2,不溶于水也不和水发生反应.
③NaHCO3的水溶液显碱性.
[设计方案]
要进一步确定粉末的成分,同学们还需要一些资料的支持,你需要查阅的资料是______.
| 商品 |  速洁粉 |  管道通 |  清垢剂 |  碱性去污粉 |
| 成分 | 碳酸钙和石英砂 | 氢氧化钠 | 氨基磺酸 | 碳酸钠或碳酸氢钠 |
[查阅资料]①氨基磺酸的化学式为NH2S03H.白色固体,常温下,氨基磺酸不吸湿,不挥发,比较稳定. 氨基磺酸的水溶液具有与盐酸、硫酸等同等的强酸性,别名固体硫酸. 氨基磺酸与清除水垢时发生如下化学反应CaCO3+2NH2SO3H=(NH2SO3)2Ca+H2O+CO2↑,氨基磺酸可以除铁锈,反应的化学方程式为______.
②石英砂:主要成分SiO2,不溶于水也不和水发生反应.
③NaHCO3的水溶液显碱性.
[设计方案]
| 实验操作 | 实验现象 | 实验结论 |
| 取固体少量与试管中,加足量水,充分振荡. | 得到无色透明溶液 | |
| ______ | ______ | 该白色固体的成分不是氨基磺酸 |
| ______ | 有气泡产生 | ______ |