题目内容
【题目】某同学将6g镁条加入到70mL的稀硫酸中,恰好完全反应,反应后所得溶液的质量为100g,试计算:
(1)原稀硫酸溶液的密度;
(2)反应后溶液中溶质的质量分数(计算结果保留一位小数)
【答案】(1)1.35g/mL(2)30%
【解析】
根据镁与硫酸反应的化学方程式,由6g镁的质量计算恰好完全反应时放出氢气的质量、参加反应的硫酸的质量、及反应生成硫酸镁的质量,然后分别利用密度的计算公式、溶液中溶质质量分数的计算公式,求出硫酸溶液的密度和反应后所得溶液中溶质的质量分数。
解:设生成氢气的质量为y,
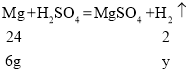
![]()
y=0.5g;
设稀硫酸溶液的质量是x,因为二者恰好完全反应,根据质量守恒定律,稀硫酸溶液的质量是:6g+x=100g+0.5g,解得稀硫酸的质量是:x=94.5g,硫酸镁的质量为:24.5g+6g-0.5g=30g,所以硫酸溶液的密度=![]() =1.35g/mL;
=1.35g/mL;
硫酸镁溶液的溶质质量分数=![]() ×100%=30%;
×100%=30%;
答:(1)硫酸溶液的密度是1.35g/mL;
(2)反应后所得溶液中溶质的质量分数为30%。

练习册系列答案
相关题目
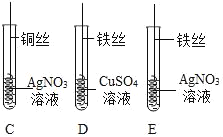
【题目】如图为某小组探究金属化学性质的两组实验。
实验I | 实验Ⅱ |
|
|
(1)实验I中以“金属表面产生气泡的快慢”为标准来判断锌铁的活动性强弱,有同学认为不够合理,理由是_____。
(2)实验Ⅱ中观察到C试管内的实验现象是_____,反应的化学方程式是_____。
(3)实验I要验证Cu、Fe、Ag的金属活动性顺序,至少要做的实验是_____(填字母序号)。如果实验室只有铜片,小华将铜片分别放入两种溶液中,也通过实验验证了三种金属的活动性顺序,所用的两种溶液是_____。