题目内容
【题目】根据图回答问题。
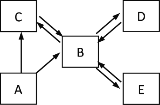
(1)A 装置中从_______(填仪器名称)装入液体药品 。
(2)实验室制取 O2、CO2 和 H2 都可以选用 (从 A、B 中选填字母序号)_______________作为发生装置;如果用 D 装置收集氧气,证明氧气已经收集满的方法是_______
(3)请写出用 A 装置制取氧气的化学反应方程式________,G 装置也可以用来制取氧气,而且它比 A 装置有更多的优点,请回答用 G 装置制取气体的一个优点________。
(4)用 B 装置制取氧气时的化学反应方程式为________。如果把 B 装置进行改进,去掉胶塞和导管,再将导管伸入试管底部就可以用来还原氧化铜,请写出用氢气还原氧化铜的化学反应方程式________。
(5)在 H 中做铁丝在氧气中燃烧的实验时,集气瓶底部要放入少量的水或铺一层细沙,其目的是____,铁丝在氧气中燃烧的化学反应方程式为______________。
(6)如图 F 装置可用于气体的收集、检验、除杂等,用该装置能完成的实验是_______(填字母序号)。
A.如果瓶内充满空气,气体从 b 端通入,收集氧气
B.如果瓶内装满水,氧气从 a 端通入,收集氧气
C.如果瓶内装有澄清石灰水,气体从 a 端通入,检验氧气中是否混有二氧化碳
D.如果瓶内装有浓硫酸,气体从 a 端通入,吸收氧气中混有的水蒸气
【答案】长颈漏斗 A 将带火星的木条放在集气瓶口,如果木条复燃,证明氧气已经收集满 2H2O2![]() 2H2O+O2↑ 可以控制反应的速率 2KClO3
2H2O+O2↑ 可以控制反应的速率 2KClO3![]() 2KCl + 3O2↑ H2+ CuO
2KCl + 3O2↑ H2+ CuO ![]() Cu + H2O 防止生成的高温熔融物溅落炸裂瓶底 2O2+ 3Fe
Cu + H2O 防止生成的高温熔融物溅落炸裂瓶底 2O2+ 3Fe![]() Fe3O4 AB
Fe3O4 AB
【解析】
(1)A 装置中从长颈漏斗装入液体药品;
(2)实验室制取 O2可用过氧化氢溶液在二氧化锰催化作用下分解生成氧气和水,制CO2 可用大理石和稀盐酸反应,制H2 可用锌与稀硫酸反应,这三种制法的反应物状态都固体和液体,不需加热,都可以选用 A作为发生装置;氧气具有助燃性,能使带火星的木条复燃。如果用 D 装置收集氧气,证明氧气已经收集满的方法是将带火星的木条放在集气瓶口,如果木条复燃,证明氧气已经收集满;
(3)过氧化氢溶液在二氧化锰催化作用下分解生成氧气和水,反应的化学方程式是2H2O2![]() 2H2O+O2↑;G 装置也可以用来制取氧气,G 装置中的注射器能控制液体的滴加速率,能控制反应的速率,它比 A 装置有更多的优点,用 G 装置制取气体的一个优点是可以控制反应的速率;
2H2O+O2↑;G 装置也可以用来制取氧气,G 装置中的注射器能控制液体的滴加速率,能控制反应的速率,它比 A 装置有更多的优点,用 G 装置制取气体的一个优点是可以控制反应的速率;
(4)由于试管口没有可棉花,若用 B 装置制取氧气,所用的试剂为氯酸钾和二氧化锰,氯酸钾在二氧化锰做催化剂加热的条件下生成氯化钾和氧气,化学反应方程式为2KClO3![]() 2KCl + 3O2↑;氢气加热还原氧化铜生成铜和水,化学反应方程式是H2+ CuO
2KCl + 3O2↑;氢气加热还原氧化铜生成铜和水,化学反应方程式是H2+ CuO ![]() Cu + H2O;
Cu + H2O;
(5)铁丝在氧气中燃烧放出大量的热。在 H 中做铁丝在氧气中燃烧的实验时,集气瓶底部要放入少量的水或铺一层细沙,其目的是防止生成的高温熔融物溅落炸裂瓶底,铁丝在氧气中燃烧生成四氧化三铁,化学反应方程式为2O2+ 3Fe![]() Fe3O4;
Fe3O4;
(6)A、氧气密度比空气大,收集氧气时,氧气从b端通入,故A正确; B、氧气不易溶于水,密度比水小,所以用装置G排水法收集氧气时,氧气从a端进入,水从b端排出,故B正确;C、瓶内装有澄清石灰水,检验氧气中是否混有二氧化碳气体,为了使气体与澄清石灰水充分接触,气体就从b端通入,故C错误;D、如果瓶内装有浓硫酸,吸收氧气中混有的水蒸气,为了使气体与浓硫酸充分接触,气体就从b端通入,故D错误。故选AB。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】实验室常用的气体发生装置如图一所示。
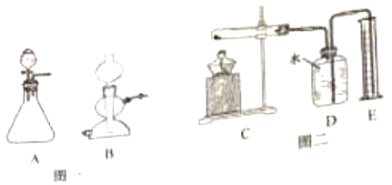
①实验室常用溶质质量分数为5%的过氧化氢溶液制取氧气,“5%”的含义是__。
②含溶质0.2mol的过氧化氢溶液完全分解,可以生成多少克氧气?___根据化学方程式列式计算),用5%的过氧化氢溶液和二氧化锰为原料制取氧气,较合理的发生装置是__(选填装置编号);
③探究溶质质量分数、催化剂质量、温度等因素对过氧化氢分解速率的影响,设计以下实验方案,其中实验甲、乙、丙的目的是__;实验戊中,w=__,t=__。
实验序号 | 过氧化氢溶液溶质质量分数 | 二氧化锰质量(g) | 温度(℃) |
甲 | 10% | 0.5 | 20 |
乙 | 10% | 1 | 20 |
丙 | 10% | 1.5 | 20 |
丁 | 5% | 1.5 | 30 |
戊 | w | 1.5 | t |
④加热氯酸钾和二氧化锰的混合物一段时间,测定生成氧气的体积,用图二所示装置进行实验(装置气密性良好)。试管中发生反应的化学方程式是__;有关该实验的说法合理的是__(选填编号)。
a.实验开始前装置D中必须装满水
b.连接C、D、E装置后点燃酒精灯
c.停止加热后,量筒内液面会下降
d.停止加热前应断开C、D装置,防止液体倒流
【题目】小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃。那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:
第一组实验:取5只集气瓶,编号为①、②、③、④、⑤,分别装入其容积10%、20%、30%、40%、50%的水,用排水法收集氧气,恰好把5只集气瓶中的水排尽。将带火星的木条依次伸入①~⑤号瓶中,记录实验现象。
小亮在前一组实验的基础上又做了第二组和第三组实验,三组实验的数据和现象见下表。
第一组 | 第二组 | 第三组 | |||||||||
集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
收集的O2占容积的体积分数(%) | 10 | 20 | 30 | 40 | 50 | 31 | 33 | 35 | 37 | 39 | 34 |
带火星的木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
请根据实验回答下列问题:
①写出一个实验室制取氧气的化学方程式_________。
②使用带火星的木条验满氧气的方法是否可靠:________(填“是”或“否”)。
③集气瓶中氧气的体积分数 = 收集的氧气占容积的体积分数 + 瓶中空气占容积的体积分数 ![]() _________%。
_________%。
④收集的氧气占容积的体积分数最低为_________%时,可使带火星的木条复燃。
⑤采取“半值法”探究能减少实验次数。例如:第一组实验若按③、④的编号顺序进行实验,即可确定下一组实验收集的氧气占容积的体积分数应在30%~40%之间,从而省去编号为①、②、⑤的实验。同理,第二组实验可以省去的实验编号为___________。
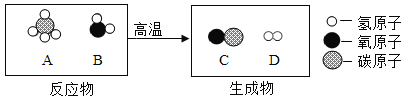
【题目】下图为某小组探究金属化学性质的两组实验。
实验I | 实验II |
|
|
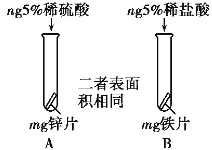
①实验I中以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为该实验设计不够合理,理由是______________;
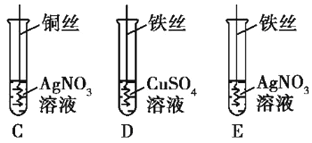
②写出实验II中C试管内反应的化学方程式_____________;
③实验II中要验证Cu、Fe、Ag的金属活动性顺序,至少要做的实验是_____(填字母序号)。