题目内容
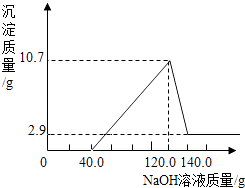
【题目】一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示,下列说法正确的是( ) 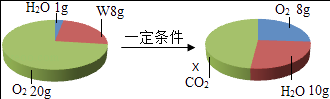
A.X的值为22
B.该反应属于置换反应
C.W由碳、氢两种元素组成
D.W中碳、氢元素原子个数比为1:4
【答案】D
【解析】解:由于四种物质中W和氧气质量减小,所以是反应物,且反应物的总质量是8g+(20g﹣8g)=20g,而水的质量增加,且增加值是10g﹣1g=9g,依据质量守恒定律参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,所以二氧化碳必是生成物且生成的质量是20g﹣9g=11g;此反应的表达式可表示为W+O2→CO2+H2O. A、X的值为11,错误;
B、由于该反应的表达式是W+O2→CO2+H2O,生成物是两种化合物,不属于置换反应,错误;
C、根据质量守恒定律,由反应表达式可以看出W中一定含有碳氢两种元素,是否含有氧元素则要通过生成物中的氧元素与反应的氧气质量进行比较,生成的水中氧元素的质量为:9g× ![]() =8g,二氧化碳中氧元素的质量:11g×
=8g,二氧化碳中氧元素的质量:11g× ![]() =8g,两者的质量和为16g,而参加反应的氧气的质量20g﹣8g=12g,所以可判断W中含有氧元素,错误;
=8g,两者的质量和为16g,而参加反应的氧气的质量20g﹣8g=12g,所以可判断W中含有氧元素,错误;
D、W中碳、氢元素原子个数比为: ![]() :
: ![]() =1:4,正确.
=1:4,正确.
故选D.
【考点精析】通过灵活运用质量守恒定律及其应用,掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏即可以解答此题.

练习册系列答案
相关题目