题目内容
【题目】硅(Si)是一种重要的半导体材料,广泛应用于电子工业的各个领域。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产流程示意图如下:
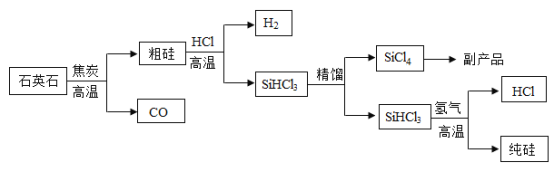
(1)硅原子的原子结构示意图为__。
(2)由石英石(SiO2)制备粗硅的化学方程式为__。
(3)“精馏”是蒸馏的一种形式,精馏过程属于__变化(填“物理”或“化学”)。
(4)由三氯甲硅烷(SiHCl3)转变为纯硅时,反应要在无氧环境中进行的原因是__。
(5)该生产工艺中可以循环使用的物质是__。
【答案】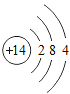
 物理 防止生成的硅被氧化,防止氢气与氧气混合,高温时发生爆炸(只回答到氢气与氧气混合,高温时发生爆炸也可得分) H2和HCl(漏写不得分)
物理 防止生成的硅被氧化,防止氢气与氧气混合,高温时发生爆炸(只回答到氢气与氧气混合,高温时发生爆炸也可得分) H2和HCl(漏写不得分)
【解析】
二氧化硅和碳酸钠高温生成硅和一氧化碳。
(1)硅原子的质子数为14,在原子中,质子数=核外电子数,故原子结构示意图为 。
。
(2)由石英石(SiO2)制备粗硅的反应是二氧化硅和焦炭高温生成硅和一氧化碳,反应的化学方程式为: ;
;
(3)“精馏”是蒸馏的一种形式,精馏过程没有新物质生成,故属于物理变化。
(4)由三氯甲硅烷(SiHCl3)转变为纯硅时,反应要在无氧环境中进行的原因是防止生成的硅被氧化,防止氢气与氧气混合,高温时发生爆炸。
(5)生产工艺中生成氢气和氯化氢,反应需要氢气和氯化氢,故该生产工艺中可以循环使用的物质是H2和HCl。

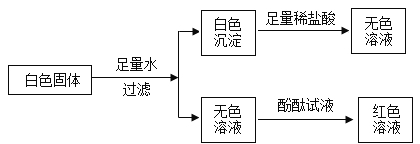
【题目】自然界并不缺少镁,缺少的是发现镁的眼睛。某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
(1)第一站:初识金属镁。(①金属镁的物理性质:____(写一条);②金属镁的化学性质:镁能与氧气反应,反应的化学方程式为___.
(2)第二站:再遇金属镁。将打磨过的镁条放入稀盐酸中,反应现象是______。化学方程式为______。
(3)第三站:制备金属镁。小组同学模拟工业上从海水晒盐剩下的苦卤中提取镁,流程如下:
![]()
流程中X为________________.
(4)第四站:再探金属镁。
(提出问题)镁能否与热水反应?如果反应,产物是什么?
(相关信息)①Mg+2H2O=Mg(OH)2+H2↑②氢氧化镁在热水中能部分溶解。
实验操作 | 实验现象 | 实验结论 |
______ | _____ | 镁能与热水反应,生成氢氧化镁和氢气 |
(5)上述寻镁之旅中你收获到镁的化学性质有_______.