题目内容
【题目】某化学兴趣小组在做“探究纯碱的性质”实验。
探究一:同学们做了如图所示的四组实验,并将A、B、C、D四支试管中的废液全部倒入一个干净的大烧杯中。考试结束后,某兴趣小组发现大烧杯底部有沉淀,上层溶液呈红色。为了探究上层溶液的成分,进行了以下实验。
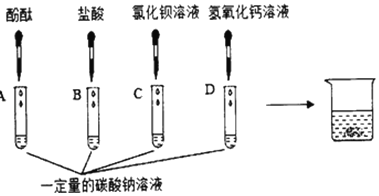
(提出问题)大烧杯中的上层溶液中除了含有水和酚酞外,还含有哪些离子?(假设难溶物质、水和酚酞均不会解离出离子)
(猜想假设)小明认为上层溶液中一定含有Na+、CO32-、H+、C1-、Ba2+、Ca2+、OH-七种离子。兴趣小组的同学对小明的猜想存在异议,并进行了下列探究
(分析讨论)(1)小红认为上层溶液中一定不含有H+,因为上层溶液呈红色。请你分析上层溶液中不含有H+的另外一个理由______。
(2)小李取一定量的上层溶液于试管中,滴加几滴稀盐酸,发现无气泡产生,认为上层溶液中一定不含有CO32-,小红认为他的结论不正确,原因______;
(设计实验)为进一步确定上层溶液中是否含有CO32-,请你和小红一起参与下列探究:
实验操作 | 实验现象 | 实验结论 |
取大烧杯中上层溶液少 许于一支试管中,滴加______,静置 | ①有白色沉淀生成 ②试管中的上层溶液仍是红色 | ①大烧杯中上层溶液中一定含有CO32- ②同时还能得出大烧杯中的上层溶液中一定含有离子是______(填离子符号) |
(实验结论)大烧杯中的上层溶液中一定含有的离子是______(填离子符号)
探究二:样品与稀硫酸反应,测定Na2CO3的质量分数
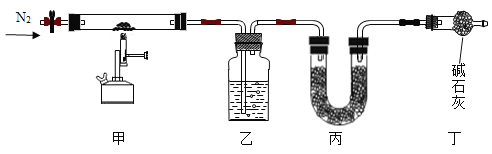
利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀硫酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好且每步反应或作用都是完全的)。
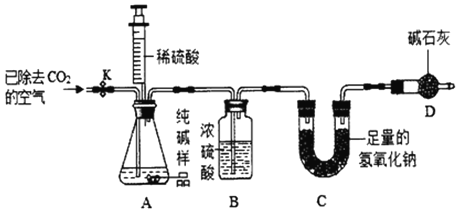
(1)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,再接上装置C和D。
(2)关闭止水夹K,加入足量的稀硫酸(杂质不与稀硫酸反应)。
(3)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一段时间的目的是______。根据质量守恒定,装置______(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数。若没有装置D,将会使测定结果______(选填“偏大”或“偏小”)。
【答案】大烧杯底部有沉淀 如果溶液中含有氢氧根离子,加入的稀盐酸不足以完全消耗氢氧根离子,即使溶液中含有碳酸根离子,也不产生气泡 足量氯化钙溶液,静置 OH- Na+、CO32-、C1-、OH- 使反应生成的二氧化碳全部被C装置吸收 C 偏大
【解析】
探究一:
(1)小红认为上层溶液中一定不含有H+,因为上层溶液呈红色,上层溶液中不含有H+的另外一个理由:大烧杯底部有沉淀。
故填:大烧杯底部有沉淀。
(2)小红认为他的结论不正确,原因:如果溶液中含有氢氧根离子,加入的稀盐酸不足以完全消耗氢氧根离子,即使溶液中含有碳酸根离子,也不产生气泡。
故填:如果溶液中含有氢氧根离子,加入的稀盐酸不足以完全消耗氢氧根离子,即使溶液中含有碳酸根离子,也不产生气泡。
[设计实验]
取大烧杯中上层溶液少许于一支试管中,滴加足量氯化钙溶液,产生白色沉淀,是因为钙离子和碳酸根离子结合生成白色沉淀碳酸钙,静置,试管中的上层溶液仍是红色,说明溶液中含有氢氧根离子,实验过程如下所示:
实验操作 | 实验现象 | 实验结论 |
取大烧杯中上层溶液少 许于一支试管中,滴加足量氯化钙溶液,静置 | ①有白色沉淀生成 ②试管中的上层溶液仍是红色 | ①大烧杯中上层溶液中一定含有CO32- ②同时还能得出大烧杯中的上层溶液中一定含有离子是OH- |
[实验结论]
溶液中含有碳酸根离子,则不含有钙离子、钡离子,因此大烧杯中的上层溶液中一定含有的离子是Na+、CO32-、C1-、OH-。
故填:Na+、CO32-、C1-、OH-。
探究二:
(3)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一段时间的目的是使反应生成的二氧化碳全部被C装置吸收;
根据质量守恒定律,装置C在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数;
若没有装置D,C装置右端的空气中的二氧化碳和水蒸气会进入C装置,导致计算的二氧化碳质量偏大,将会使测定结果偏大。
故填:使反应生成的二氧化碳全部被C装置吸收;C;偏大。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案