题目内容
有一包白色粉末,可能是碳酸钠、氢氧化镁、氯化钡、硫酸钠、硝酸钠中的一种或几种,现做如下实验:a 取少量粉末放在烧杯中,加足量水、搅拌、静置、过滤,得无色溶液和白色沉淀
b 向滤出的沉淀中加足量的稀硝酸,沉淀全部溶解,无气体产生
c 向滤液中滴加硝酸银溶液,立即有白色沉淀生成,再加稀硝酸,沉淀不溶解
(1)根据以上现象推断,用化学式填空:该粉末中一定含有 一定不含 可能含
(2)写出上述b c两步的化学方程式 .
【答案】分析:推断题是初中化学试题中常见但却十分重要的一类题型.解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口,即重要的现象特征、反应特征及结构特征等,导出结论.本题的突破口:①白色沉淀和无色滤液;②白色沉淀中加入稀硝酸,沉淀全部溶解,无气体产生;③加入硝酸银溶液,生成白色沉淀,加稀硝酸,沉淀不消失.
解答:解:a、将少量粉末放在烧杯中,加足量水、搅拌、静置、过滤,得白色沉淀和无色滤液,则白色沉淀可能为氢氧化镁、碳酸钡、硫酸钡中的一种或几种.
b、向过滤所得沉淀中,加足量稀硝酸,沉淀全部溶解,无气体产生.说明沉淀不是硫酸钡和碳酸钡,那么就是氢氧化镁.因为碳酸钡与硝酸反应生成二氧化碳气体,而硫酸钡不与硝酸反应.故溶液中一定含有氢氧化镁;
c、向滤液中滴加硝酸银溶液,立即有较多的白色沉淀生成,再加稀硝酸,沉淀不溶解.加入硝酸银溶液,生成白色沉淀,加稀硝酸,沉淀不消失:则沉淀为氯化银;而氯离子来自氯化钡,故溶液中一定含有氯化钡,一定不含碳酸钠和硫酸钠,因为碳酸钠和硫酸钠能和氯化钡反应生成碳酸钡沉淀和硫酸钡沉淀,不符合第二步的实验现象.溶液中是否含有硝酸钠对反应现象没有影响.
(1)由分析可知该粉末中一定含有Mg(OH)2、BaCl2;一定不含Na2SO4、Na2CO3;可能含NaNO3;
(2)b c两步的化学方程式Mg(OH)2+2HNO3=Mg(NO3)2+2H2O;BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2;
故答案为:(1)Mg(OH)2、BaCl2;Na2SO4、Na2CO3;NaNO3;(2)Mg(OH)2+2HNO3=Mg(NO3)2+2H2O;BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2;
点评:解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口,导出结论,最后把结论代入原题中验证.
解答:解:a、将少量粉末放在烧杯中,加足量水、搅拌、静置、过滤,得白色沉淀和无色滤液,则白色沉淀可能为氢氧化镁、碳酸钡、硫酸钡中的一种或几种.
b、向过滤所得沉淀中,加足量稀硝酸,沉淀全部溶解,无气体产生.说明沉淀不是硫酸钡和碳酸钡,那么就是氢氧化镁.因为碳酸钡与硝酸反应生成二氧化碳气体,而硫酸钡不与硝酸反应.故溶液中一定含有氢氧化镁;
c、向滤液中滴加硝酸银溶液,立即有较多的白色沉淀生成,再加稀硝酸,沉淀不溶解.加入硝酸银溶液,生成白色沉淀,加稀硝酸,沉淀不消失:则沉淀为氯化银;而氯离子来自氯化钡,故溶液中一定含有氯化钡,一定不含碳酸钠和硫酸钠,因为碳酸钠和硫酸钠能和氯化钡反应生成碳酸钡沉淀和硫酸钡沉淀,不符合第二步的实验现象.溶液中是否含有硝酸钠对反应现象没有影响.
(1)由分析可知该粉末中一定含有Mg(OH)2、BaCl2;一定不含Na2SO4、Na2CO3;可能含NaNO3;
(2)b c两步的化学方程式Mg(OH)2+2HNO3=Mg(NO3)2+2H2O;BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2;
故答案为:(1)Mg(OH)2、BaCl2;Na2SO4、Na2CO3;NaNO3;(2)Mg(OH)2+2HNO3=Mg(NO3)2+2H2O;BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2;
点评:解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口,导出结论,最后把结论代入原题中验证.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
(1)有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成,为检验其中的成分,经实验得到下表,请完成相关内容.
(2)某化学兴趣小组为测定该包白色粉末中碳酸钠的质量分数,取该样品44.6g,加286.2克水溶解制成溶液后投入146克稀盐酸中完全反应,共收集到二氧化碳气体8.8g.求:(1)该碳酸钠样品中碳酸钠的质量分数;(2)反应所得溶液中溶质的质量分数.
| 实验步骤及现象 | 结论 |
| ①将少许白色粉末溶于水得到无色溶液A | 白色粉末中一定没有 |
| ②在A中加入足量硝酸钡溶液,生成白色沉淀B,过滤得滤液C ③在白色沉淀B中加入足量稀硝酸, ④在滤液C中加入硝酸银溶液,出现白色沉淀,再滴加稀硝酸,沉淀不溶解. |
白色粉末中一定有 碳酸钠和氯化钠 |

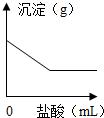 (2013?长宁区二模)有一包白色粉末,可能含有K2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种.取样溶于足量的水,有白色沉淀产生,过滤,滤液呈无色;向沉淀中滴加稀盐酸,沉淀的质量与加入盐酸体积的关系如图所示.由此推断白色粉末的成分是( )
(2013?长宁区二模)有一包白色粉末,可能含有K2SO4、Na2CO3、BaCl2、CuSO4中的一种或几种.取样溶于足量的水,有白色沉淀产生,过滤,滤液呈无色;向沉淀中滴加稀盐酸,沉淀的质量与加入盐酸体积的关系如图所示.由此推断白色粉末的成分是( )