题目内容
(7分)根据实验内容回答问题。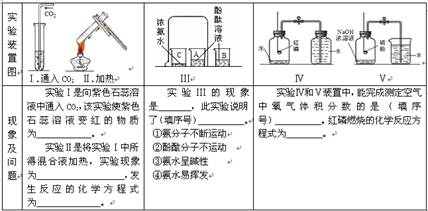

(1)H2CO3 溶液由红色变为紫色 H2CO3= CO2↑+ H2O
(2)A中溶液由无色变为红色,B、C溶液不变色 ①③④
(3)Ⅴ 4P + 5O2 2P2O5
2P2O5
(2)A中溶液由无色变为红色,B、C溶液不变色 ①③④
(3)Ⅴ 4P + 5O2
 2P2O5
2P2O5试题分析:(1)通入二氧化碳,能使紫色石蕊溶液变色的是碳酸,因为二氧化碳与水反应生成碳酸,碳酸为酸,可使紫色石蕊溶液变色;碳酸不稳定,加热实验Ⅰ中所得混合液,碳酸会分解,所以溶液又恢复为紫色,即H2CO3= CO2↑+ H2O。
(2)因为氨水易挥发,即氨气分子运动速度比酚酞分子快的多,氨气分子进入到酚酞分子中,又因为氨水呈碱性,所以可使酚酞变红色,即A中溶液由无色变为红色,B、C溶液不变色。
(3)红磷燃烧,即4P + 5O2
 2P2O5,虽然消耗氧气,但为密闭容器,没形成气压差;硫燃烧生成二氧化硫,二氧化硫被氢氧化钠溶液吸收,集气瓶内外形成气压差,所以大气压把水压入集气瓶,并且进入的水的体积大约就是消耗氧气的体积,故选Ⅴ。
2P2O5,虽然消耗氧气,但为密闭容器,没形成气压差;硫燃烧生成二氧化硫,二氧化硫被氢氧化钠溶液吸收,集气瓶内外形成气压差,所以大气压把水压入集气瓶,并且进入的水的体积大约就是消耗氧气的体积,故选Ⅴ。点评:解答本题,除了要熟练掌握以上考点的知识之外,还要能根据具体问题情境具体分析,如第三个实验,就不能生搬硬套教材上的实验,否则就会出错。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目







