题目内容
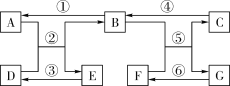
【题目】为验证“酸的化学通性”,某班同学在实验室进行如下实验。请分析并回答相关问题:
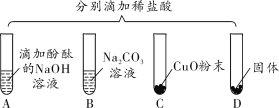
(1)写出能证明A中反应发生的现象_____。
(2)写出上述实验中酸与金属氧化物反应的化学方程式_____。
(3)要全面验证酸的化学通性,D试管中能与酸反应的固体单质是_____(写一种即可)。
(4)实验完成后,将全部废液倒入废液缸内,测得pH=2,则废液中所含溶质最多有_____种(溶质不计指示剂与气体)。
【答案】红色消失(或红色褪去或溶液由红色逐渐变为无色) CuO+2HCl=CuCl2+H2O 镁(或铝、锌、铁等合理即可,写化学式也可) 四(或4)
【解析】
氢氧化钠溶液能使无色酚酞溶液变成红色,滴加稀盐酸后,氢氧化钠溶液与稀盐酸反应,溶液红色褪去;氧化铜是金属氧化物,与稀盐酸反应生成氯化铜和水;酸的通性包括酸能与指示剂反应,酸能与某些盐反应,酸能与碱反应,酸能与金属氧化物反应,酸能与活动性较强的金属反应,要全面验证酸的化学性质,D应该是活动性较强的金属,如铁、镁等。

【题目】(7分)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
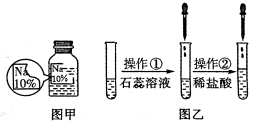
【猜想与假设】其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
【资料查阅】上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
【探究过程】
如图乙所示,在操作①后可确定溶质不是NaCl,则其实验现象应是 ;
在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的 。
【探究结论】
你认为该溶液中的溶质可能是上述假设物质中的 ,你的判断依据是 。
【探究反思】
(1)若上述探究结论是正确的,操作②产生的气体应是 (写化学式),实验室检验该气体的实验操作及现象是 。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由: 。
【题目】在学习金属的化学性质时,王明发现铝的化学性质活泼,但打磨后的铝与稀盐酸反应快,而与稀硫酸反应的速率却非常慢,对此,他向老师提出疑问,并在老师的帮助下,完成了以下探究活动,请你和他一起完成:
(提出问题)铝与稀硫酸反应的速率慢与哪些因素有关?
(猜想与假设)铝与稀硫酸反应时所用稀硫酸浓度太小。
请你写出铝和稀硫酸反应的化学方程式___________。
老师为大家准备了以下实验用品:大小相同的铝片、10%的稀硫酸、30%的稀硫酸、氯化钠、硫酸钠、试管、试管夹、酒精灯、镊子、药匙、砂纸。
(设计实验)(1)王明为探究假设是否成立,设计了如下实验:
操作步骤 | 现象 | 结论 |
将打磨后的铝片放入试管中,加入_______ | 有少量气 泡产生 | 假设不成立 |
将打磨后的铝片放入试管中,加入____ | 有少量气 泡产生 |
(2)针对以上异常现象,老师给大家提示,铝与稀盐酸反应快,而与稀硫酸反应慢,可能与两种酸中的酸根离子有关,为了证明这一假设,同学们设计了如下实验:
操作步骤 | 现象 | 结论 |
将打磨后的铝片放入试管中,加入30%的稀硫酸和______ | 有较多 气泡产生 | 假设成立 |
将打磨后的铝片放入试管中,加入30%的稀硫酸和______ | 有少量 气泡产生 |
(反思与评价)(1)你认为除了以上因素,还有哪些因素会影响化学反应速率________。
(2)为什么铝制品有较好的抗腐蚀性?_________。