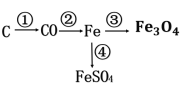
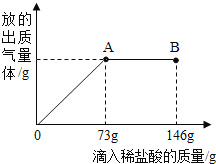
题目内容
【题目】化学兴趣小组的同学在实验室中用加热4.9g氯酸钾和1.58g高锰酸钾混合物的方法进行了制取氧气的研究,得到如图所示的曲线图。试回答:
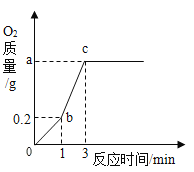
(1)b~c段产生氧气的速度明显比O~b段加快,其原因是______。
(2)反应结束后所得固体混合物中质量分数最大的物质的质量分数是多少?___(写出计算过程,精确到小数点后一位)
【答案】高锰酸钾分解产生的二氧化锰作为催化剂,加速了氯酸钾的分解 67.73%(详见解析)
【解析】
(1)b~c段产生氧气的速度明显比为O~b段加快,其原因是高锰酸钾分解产生的二氧化锰作为催化剂,加速了氯酸钾的分解;
(2)c点时氧气不再增加,生成氧气的质量就是4.9g氯酸钾和1.58g高锰酸钾全部分解所产生的氧气质量。
设:氯酸钾分解得到氯化钾的质量为x。
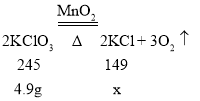
![]() ,x=2.98g;生成氧气的质量=4.9-2.98=1.92g;
,x=2.98g;生成氧气的质量=4.9-2.98=1.92g;
设:高锰酸钾分解得到氧气的质量为y。

![]() ,y=0.16g;
,y=0.16g;
1.58gKMnO4分解,生成的其他固体的质量肯定小于KCl的2.98g,故剩余固体混合物中质量分数最大的只能是KCl;剩余固体混合物的质量为4.9g+1.58g-1.92g-0.16g=4.4g;
KCl的质量分数=![]() 。
。
答:固体混合物中KCl的质量分数最大,其数值为67.73%。

练习册系列答案
相关题目
【题目】下表是几种原子或分子的示意图,根据图示的反应历程判断,下列说法错误的是( )
图例 |
|
|
|
|
|
|
|
|
原子或分子 | 1个A原子 | 1个B原子 | 1个C原子 | 1个D原子 | 1个AD2分子 | 1个B2分子 | 1个BD2分子 | 1个CB分子 |
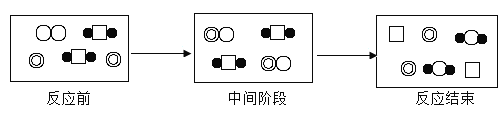
A.该反应是置换反应B.反应中间阶段发生了化合反应
C.反应结束阶段发生了复分解反应D.物质C是反应的催化剂