题目内容
【题目】实验室里常用锌粒与稀盐酸HCl在常温下反应制取氢气,同时生成氯化锌。氢气是一种无色、无味的气体,它的密度比空气小,难溶于水。氢气是一种最清洁的燃料,因为它燃烧只生成水,不污染环境。
(1)请你写出在实验室里制取氢气的化学反应方程式_____。
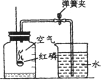
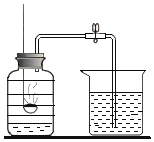
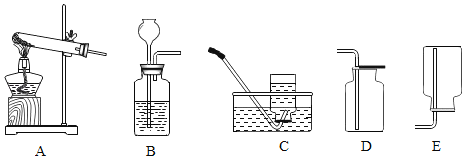
(2)制取氢气时,发生装置你想选用如图所示的_____装置,理由是_____;收集装置应选用如图所示_____或_____装置。
(3)请你写出纯净的氢气在空气中安静燃烧生成水的化学反应方程式:_____。
【答案】Zn+2HCl=ZnCl2+H2↑ B 反应物是固体与液体,反应无需加热 C E 2H2+O2![]() 2H2O
2H2O
【解析】
(1)实验室中常用锌和稀盐酸反应制取氢气,同时生成氯化锌,反应的化学反应方程式是:Zn+2HCl=ZnCl2+H2↑;故填:Zn+2HCl=ZnCl2+H2↑
(2)该反应的反应物是固体与液体,反应是在常温下进行的,所以选择装置B来制取,氢气的密度比空气小,难溶于水,所以可用向下排空气法或排水法来收集;故填:B;反应物是固体与液体,反应无需加热;C;E
(3)氢气和氧气在点燃的条件下反应生成水;故填:2H2+O2![]() 2H2O
2H2O

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
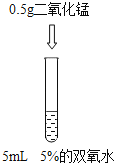
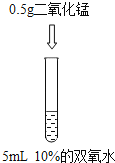
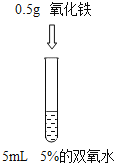
【题目】为了探究”影响双氧水制氧气的速率”的因素,某学习小组设计了下列实验,下列说法正确的是( )
实验① | 实验② | 实验③ |
|
|
|
A. 对比实验②和③,可研究双氧水的质量分数对反应速率的影响
B. 对比实验①和②,可研究双氧水的质量分数对反应速率的影响
C. 对比实验②和③,可研究催化剂的种类对反应速率的影响
D. 对比实验①和②,可研究催化剂的种类对反应速率的影响