题目内容
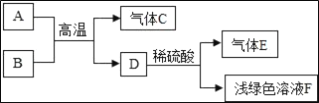
【题目】现有一包固体粉末,可能含有Cu、Fe2O3、CuSO4、NaCl、Na2SO4中的一种或几种,为确定其成分按如图所示进行实验,出现的现象如图中所述(设过程中所有发生的化学反应都恰好完全反应):
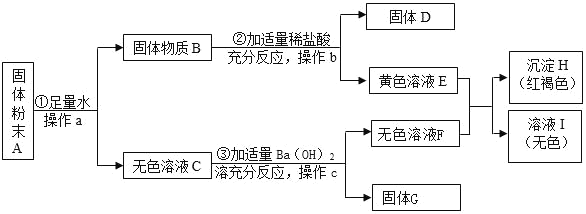
根据实验过程中的现象判断:
(1)固体D的化学式是_____,红褐色沉淀H的化学式是_____。
(2)a、b、c表示同一操作,其名称是_____。
(3)无色溶液C中 一定含有的酸根离子是_____,无色溶液I中一定含有的金属离子是_____。
(4)写出过程③发生的化学方程式_____。
(5)固体粉末A中一定含有的物质是_____。
(6)固体粉末A中一定不含的物质是_____。原因是_____。
【答案】Cu Fe(OH)3 过滤 硫酸根离子 钠离子 Na2SO4+Ba(OH)2=BaSO4↓+2NaOH Cu、Fe2O3、Na2SO4 CuSO4 溶液C是无色的
【解析】
固体粉末A加入足量水,过滤,得到固体物质B和无色溶液C,硫酸铜显蓝色,则A中不含硫酸铜,黄色溶液E和无色溶液F会生成红褐色沉淀H,所以H是氢氧化铁沉淀,F中含有氢氧根,E是B中加入盐酸生成的,所以E中含有氯化铁,铜和氧化铁都难溶于水,所以B中含有氧化铁和铜,D是铜,C和氢氧化钡反应会生产白色沉淀,所以C中含有硫酸钠,硫酸钠和氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,所以F是氢氧化钠,G是硫酸钡,氢氧化钠和氯化铁反应生成氢氧化铁沉淀和氯化钠,所以I中一定含有氯化钠,A中含有氧化铁、铜、硫酸钠。
(1)E是B中加入盐酸生成的,所以E中含有氯化铁,铜和氧化铁都难溶于水,所以B中含有氧化铁和铜,D是铜,固体D的化学式是![]() ;黄色溶液E和无色溶液F会生成红褐色沉淀H,所以H是氢氧化铁沉淀,红褐色沉淀H的化学式是
;黄色溶液E和无色溶液F会生成红褐色沉淀H,所以H是氢氧化铁沉淀,红褐色沉淀H的化学式是![]() 。
。
(2)a、b、c表示同一操作,是将固体和液体分离,其名称是过滤。
(3)C和氢氧化钡反应会生产白色沉淀,所以C中含有硫酸钠,无色溶液C中 一定含有的酸根离子是硫酸根离子,氢氧化钠和氯化铁反应生成氢氧化铁沉淀和氯化钠,所以I是氯化钠,无色溶液I中一定含有的金属离子是钠离子。
(4)C和氢氧化钡反应会生产白色沉淀,所以C中含有硫酸钠,硫酸钠和氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,所以F是氢氧化钠,G是硫酸钡,故过程③发生的化学方程式为
![]() 。
。
(5)固体粉末A中一定含有的物质是Cu、Fe2O3、Na2SO4。
(6)固体粉末A中一定不含的物质是CuSO4;原因是硫酸铜溶液呈蓝色,而溶液C是无色的。

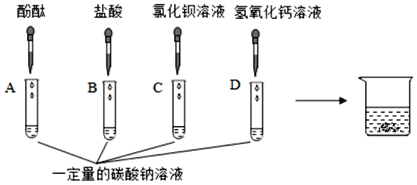
【题目】某化学兴趣小组在做“探究纯碱的性质”实验。
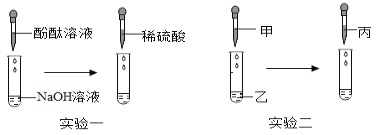
探究一:同学们做了如图所示的四组实验,并将A、B、C、D四支试管中的废液全部倒入一个干净的大烧杯中。考试结束后,某兴趣小组发现大烧杯底部有沉淀,上层溶液呈红色。为了探究上层溶液的成分,进行了以下实验。
(提出问题)大烧杯中的上层溶液中除了含有水和酚酞外,还含有哪些离子?(假设难溶物质、水和酚酞均不会解离出离子)
(猜想假设)小明认为上层溶液中一定含有Na+、CO32﹣、H+、Cl﹣、Ba2+、Ca2+、OH﹣七种离子,你认为上层溶液中含有的离子最多可能有哪几种,它们分别是_____(填离子符号)。
(分析讨论)(1)小红认为上层溶液中一定不含有H+,因为上层溶液呈红色。请你分析上层溶液中不含有H+的另外一个理由_____。
(2)小李取一定量的上层溶液于试管中,滴加几滴稀盐酸,发现无气泡产生,认为上层溶液中一定不含有CO32﹣.小红认为他的结论不正确,原因是_____。
(设计实验)为进一步确定上层溶液中是否含有CO32﹣,请你和小红一起参与下列探究:
实验操作 | 实验现象 | 实验结论 |
取大烧杯中上层溶液少许于一支试管中,滴加_____,静置 | ①_____ ②试管中的上层溶液仍是红色 | ①大烧杯中上层溶液中一定含有CO32﹣ ②同时还能得出大烧杯中的上层溶液中一定含有离子是_____(填离子符号) |
(实验结论)大烧杯中的上层溶液中一定含有的离子是_____(填离子符号)。
探究二:“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行测定。
(查阅资料)碱石灰是氧化钙与氢氧化钠固体的混合物,具有良好的吸水性还能吸收酸性气体;
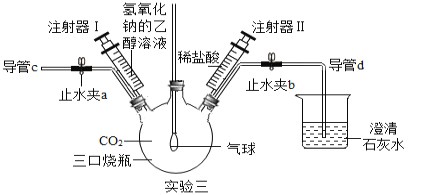
(设计实验)根据如图的装置,他们设计了以下实验方案进行试验。
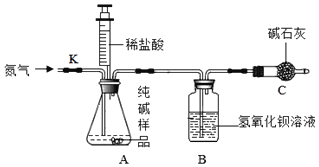
(1)如图装配好仪器,并检查装置气密性,准确称量5.0g的纯碱样品加入A中的锥形瓶,并在各装置中加入足量药品。
(2)打开止水夹K,先对装置A通入已除去氮气一会儿,再连接上装置B和C。
(3)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为_____。
(4)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入氮气一会儿。
(5)将反应后B装置内的混合物进行过滤,把获得的沉淀物进行、称量,利用沉淀物质量计算Na2CO3的质量分数。
(实验反思)
(1)实验设计中若没有装置C则本次测定的实验结果会_____(填“偏大”、“偏小”或“无影响”)
(2)老师在查看小组的实验设计后指出,该实验设计即使各步骤实验过程操作规范,测量数据准确,但最后的结果也会偏小,请你分析原因。_____。