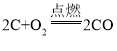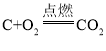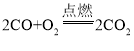题目内容
【题目】Cu-Mg合金具有优良的导电性,常用作飞机导线。现要测定该合金的组成,进行如下实验:取Cu-Mg合金20g放入烧杯中,将280g稀H2SO4分4次分别加入烧杯。充分反应后,测得剩余固体的质量记录如下表所示:
次数 | 1 | 2 | 3 | 4 |
加入稀H2SO4的质量 /g | 70 | 70 | 70 | 70 |
剩余固体的质量/g | 18.2 | 16.4 | 14.6 | 13.2 |
求:(1)20g合金中铜(Cu)、镁(Mg)的质量。_____
(2)所用稀H2SO4 中溶质的质量分数。______
(3)第1次反应后所得溶液中溶质的质量分数。(计算结果精确到0.1%)_____
【答案】13.2g、6.8g 10.5% 12.6%
【解析】
镁的金属活动性排在氢的前面,镁和稀硫酸反应生成硫酸镁和氢气,铜的金属活动性排在氢的后面,铜和稀硫酸不反应。
(1)根据表格中的数据,第1次加入70g稀硫酸,参加反应的镁的质量为![]() ;第2次加入70g稀硫酸,参加反应的镁的质量为
;第2次加入70g稀硫酸,参加反应的镁的质量为![]() ;第3次加入70g稀硫酸,参加反应的镁的质量为
;第3次加入70g稀硫酸,参加反应的镁的质量为![]() ;第4次加入70g稀硫酸,参加反应的镁的质量为
;第4次加入70g稀硫酸,参加反应的镁的质量为![]() ;说明第4次加入的稀硫酸过量,剩余固体为不反应的铜,故20g合金中铜(Cu)的质量为13.2g,镁(Mg)的质量为
;说明第4次加入的稀硫酸过量,剩余固体为不反应的铜,故20g合金中铜(Cu)的质量为13.2g,镁(Mg)的质量为![]() 。
。
(2)设所用稀H2SO4 中溶质的质量分数为x
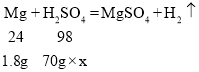
![]()
![]()
故所用稀H2SO4 中溶质的质量分数为10.5%。
(3)设第1次反应后所得溶液中溶质的质量为y,生成的氢气的质量为z
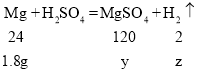
![]()
![]()
故第1次反应后所得溶液中溶质的质量分数为![]()

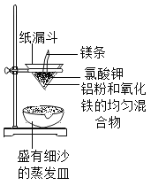
【题目】铝和氧化铁的反应:2A1+Fe2O3![]() Al2O3+2Fe,称为“铝热反应”(如图所示),引燃镁条,漏斗内的物质熔化,镁条燃尽,漏斗下端仍持续产生大量熔融物落入沙中,该熔融物可用于焊接铁轨。
Al2O3+2Fe,称为“铝热反应”(如图所示),引燃镁条,漏斗内的物质熔化,镁条燃尽,漏斗下端仍持续产生大量熔融物落入沙中,该熔融物可用于焊接铁轨。
(1)实验中镁条的作用是_____;氧化铁和铝粉都用粉末状的,原因是_____。
(2)某学习兴趣小组对所得熔融物的成分进行了探究。
(查阅资料)
①金属铝不但能和酸溶液(如稀盐酸)反应产生氢气,还能和强碱溶液(如氢氧化钠溶液)反应产生氢气。
②Al、A12O3、Fe、Fe2O3的熔点、沸点数据如下:
物质 | A1 | Al2O3 | Fe | Fe203 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | - |
(实验猜想)
(3)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放热能使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?_____(填“合理”或“不合理”)。
(4)铝与稀盐酸反应的化学方程式为_____。
(5)请你根据已有知识找出一种验证产物中有Fe的最简单的方法:_____。
(实验验证)
(6)设计一个简单的实验方案,证明上述所得的熔融物中含有金属铝,请填写下列表格:
实验步骤 | 实验现象 | 实验结论 |
取少量冷却后的熔融物于试管中,加入_____ | _____ | 熔融物中含有铝 |