题目内容
【题目】下列有关水的说法正确的是
A.淡水资源是取之不尽的B.水电解时生成氢气和氧气的质量比为2∶1
C.将硬水过滤可以得到软水D.净水的方法有沉淀、过滤、吸附、蒸馏等
【答案】D
【解析】
A、地球上的淡水资源储量小且分布不均匀,水污染也很普遍,因此淡水资源不是取之不尽,用之不竭的,故A说法不正确;
B、水电解时生成氢气和氧气的体积比为2:1,质量比是1:8,故B说法不正确;
C、加热煮沸能减少钙、镁化合物的含量,将硬水加热煮沸可以降低水的硬度,过滤不能将硬水软化,故C说法不正确;
D、净水的方法有沉淀、过滤、吸附、蒸馏等,故D说法正确。
故选:D。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案【题目】我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献。其生产工艺流程示意图如下: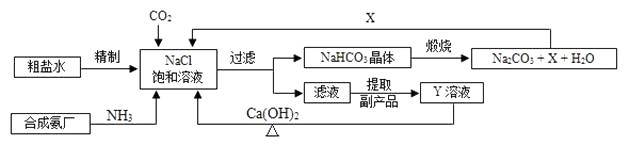
(1)粗盐水中主要含有Ca2+、Mg2+、SO42-等杂质离子,工业上常用加入稍过量的① NaOH溶液、② Na2CO3溶液、③ BaCl2溶液及适量的盐酸等除杂、精制。则加入试剂合理的顺序为(填字母序号)。
A.①②③
B.③②①
C.①③②
(2)加盐酸的作用是(用方程式表示)、。
(3)制碱原理可看作是由① CO2 + NH3 + H2O = NH4HCO3和② NaCl + NH4HCO3 = NaHCO3+ NH4Cl两个反应加合而成。反应②为复分解反应,请根据复分解反应发生的条件及表1中相关物质20℃时的溶解度,分析反应②为何能顺利进行?。
表1 相关物质的溶解度(20℃)(单位:g)
NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
36.0 | 21.7 | 9.6 | 37.2 |
(4)操作2为洗涤、煅烧。晶体应在以下装置中(填字母序号)进行“洗涤”操作。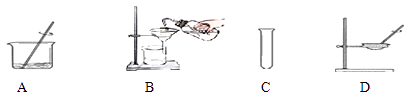
在上述操作中,如何判断晶体已经洗涤干净。
(5)X的化学式为 , 若X直接排放到空气中会造成的后果是。
(6)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为 , Y的化学式为 , 写出Y的一种用途。
【题目】元素周期表是学习化学的重要工具。下图是元素 周期表的一部分。
第三周期 | ① | 12 Mg | 13 | 14Si | l5P | 16S | 17CI | 18 Ar |
构成物质硅的微粒是_______________;①的核外电子数为____________;13号元素与空气中含量占第二的元素组成的物质的化学式为______。