题目内容
【题目】我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献。其生产工艺流程示意图如下: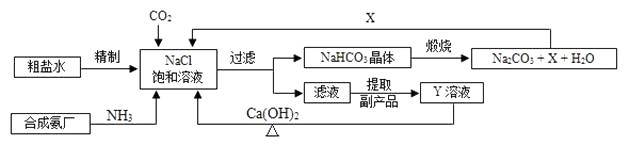
(1)粗盐水中主要含有Ca2+、Mg2+、SO42-等杂质离子,工业上常用加入稍过量的① NaOH溶液、② Na2CO3溶液、③ BaCl2溶液及适量的盐酸等除杂、精制。则加入试剂合理的顺序为(填字母序号)。
A.①②③
B.③②①
C.①③②
(2)加盐酸的作用是(用方程式表示)、。
(3)制碱原理可看作是由① CO2 + NH3 + H2O = NH4HCO3和② NaCl + NH4HCO3 = NaHCO3+ NH4Cl两个反应加合而成。反应②为复分解反应,请根据复分解反应发生的条件及表1中相关物质20℃时的溶解度,分析反应②为何能顺利进行?。
表1 相关物质的溶解度(20℃)(单位:g)
NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
36.0 | 21.7 | 9.6 | 37.2 |
(4)操作2为洗涤、煅烧。晶体应在以下装置中(填字母序号)进行“洗涤”操作。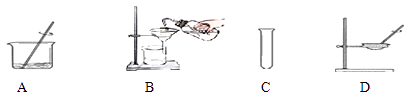
在上述操作中,如何判断晶体已经洗涤干净。
(5)X的化学式为 , 若X直接排放到空气中会造成的后果是。
(6)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为 , Y的化学式为 , 写出Y的一种用途。
【答案】
(1)B,C
(2)NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+ H2O+ CO2↑
(3)NaHCO3的溶解度较低,析出晶体
(4)B,取最后一次洗涤液,滴加硝酸银溶液,若没有沉淀则已洗涤干净
(5)CO2,温室效应
(6)氨气,NH4Cl,做氮肥
【解析】解:(1)加入碳酸钠的作用有两个:一个是除去溶液中的Ca2+、另一个是除去过量的氯化钡,所以加入的碳酸钠必须排在氯化钡的后面,所以顺序是NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH;(2)加入盐酸的目的是除去过量的氢氧化钠和过量的碳酸钠;(3)由NaCl + NH4HCO3 = NaHCO3+ NH4Cl可知,碳酸氢钠和氯化铵的质量比为84:53.5,碳酸氢钠生成的多,但是溶解度很小,20℃时的溶解度为9.6g,所以生成的碳酸氢钠大都以晶体存在,类似于沉淀,符合复分解反应的条件,所以反应能顺利进行;(4)为了能将洗涤的液体与固体及时分离,所以洗涤时应用装置B,如果洗涤干净则洗涤所得溶液中没有氯化铵,所以判断晶体已经洗涤干净的方法是:取最后一次洗涤液,滴加硝酸银溶液,若没有沉淀则已洗涤干净;(5)碳酸氢钠在加热条件下分解生成碳酸钠和二氧化碳、水,所以X的化学式为CO2,直接排放会导致温室效应;(6)滤液中最主要成分是氯化铵,氯化铵与Ca(OH)2反应的产物是氨气、氯化钙、水,氨气可用于循环使用, 氯化铵的化学式为NH4Cl,因含氮元素,可做氮肥。
所以答案是:(1)BC;(2)NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+ H2O+ CO2↑;(3)NaHCO3的溶解度较低,析出晶体;(4)B;取最后一次洗涤液,滴加硝酸银溶液,若没有沉淀则已洗涤干净;(5)CO2;温室效应;(6)氨气;NH4Cl;做氮肥。
【考点精析】利用结晶的原理、方法及其应用和书写化学方程式、文字表达式、电离方程式对题目进行判断即可得到答案,需要熟知结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3);注意:a、配平 b、条件 c、箭号.

【题目】鸡蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,其中蛋壳的主要成分是CaCO3 , 里面覆盖一层蛋壳膜。我校兴趣小组的同学为此开展了以下探究活动:
【提出问题1】
(1)鸡蛋白中含有的营养成分是。
(2)【查阅资料】
A.蛋壳是经过自然形成。科学手段检测蛋壳中含CaCO3约82%—85%,蛋白质15%—17%,并含多种微量元素;
b.蛋壳膜中蛋白质约占90%—93%。
【提出问题2】
蛋壳中的CaCO3含量是多少呢?小华拟将该蛋壳放在空气中充分灼烧完成测定;小明拟通过蛋壳与稀盐酸反应完成测定。请你参与他们的探究。
【设计方案】他们分别称取12.0 g蛋壳设计了以下不同的实验方案:
小华的方案:
称取12.0 g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16g。则:产生的CO2质量g,蛋壳中的CaCO3的质量分数为%(结果保留到小数点后一位)。
(3)小明的方案:小明设计了如下图所示的实验装置。(已知其他成分均不与稀盐酸反应,装置内试剂均足量)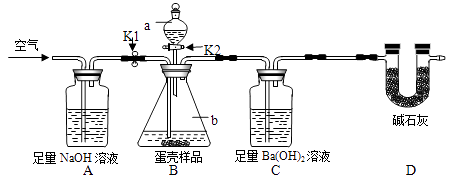
【实验步骤】
① 出编号仪器的名称:a , b;
② 按上图连接好装置后,并;
③ 向B装置中加入蛋壳样品后,先通入空气一会儿;
④ K1 , K2(填“打开”或“关闭”),向蛋壳样品中滴入10%的盐酸,直到B中为止(填实验现象);
⑤ 再通入一会儿空气,目的是;
⑥ 将装置C中的固液混合物过滤、洗涤、干燥后称量其质量;
⑦ 重复上述实验。
(4)【实验数据】重复实验,3次数据记录如下:
实验次数 | 实验1 | 实验2 | 实验3 |
装置C中沉淀质量(g) | 19.68 | 19.75 | 19.67 |
【实验分析及数据处理】
① 上述数据能否用托盘天平称量。(填“能”或“不能”)
② 若无A装置,直接通入空气,则测定结果将。(填“偏大”、“偏小”或“不变”)
③ 实验重复3次的目的是。
④ 请利用3次实验数据的平均值,计算该蛋壳中的CaCO3含量(已知:BaCO3相对分子量为197,结果保留到小数点后一位)。(请写出具体的计算过程,该空2分)
(5)【实验反思】
①下列各项措施中,能提高小明测定准确度的是(填字母序号)。
A.在装置A、B之间增加盛有浓硫酸的洗气瓶
B.缓缓滴加稀盐酸
C.在装置B、C之间增加盛有饱和NaHCO3的洗气瓶
②大家讨论后,一致认为小明的方案更合理,你认为小华方案存在较大误差的原因主要是。
