题目内容
【题目】已知空气的主要成分是氮气和氧气。某课外活动小组设计了测定空气中氧气含量的实验。
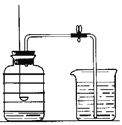
实验装置如图所示:
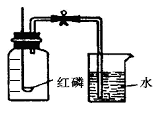
(1)该实验中红磷需稍过量,目的是______________。
(2)待燃烧停止,白烟消失并冷却后,打开止水夹,观察到烧杯中的水进入集气瓶。由此可得氧气约占空气总体积的________ 。由本实验还可推知氮气的哪一些性质?试写出其中的一条_________________。
(3)若将红磷换成碳粉,该实验能否获得成功?_______ (填“能”或“否”)。理由是_______________。
(4)红磷熄灭后,打开止水夹后,发现最终进入集气瓶的水的体积小于1/5,试分析其可能的原因(至少写三点): ; ; 。
【答案】(1)用红磷完全消耗瓶中空气里的氧气
(2)1/5 氮气难溶于水(或氮气不燃烧,也不支持燃烧)
(3)否 碳粉燃烧产物是二氧化碳气体
(4)红磷的用量不足 装置的密封性不好 没有冷却到室温就打开止水夹
【解析】
试题分析:(1) 该实验中红磷需稍过量,目的是:用红磷完全消耗瓶中空气里的氧气,这样使测量结果更准确
(2) 待燃烧停止,白烟消失并冷却后,打开止水夹,观察到烧杯中的水进入集气瓶,且约占集气瓶总体积的1/5,由此可得氧气约占空气总体积的1/5;由于氧气被消耗,剩余的气体主要是氮气,而红磷没有继续燃烧,说明氮气氮气不燃烧,也不支持燃烧;水进入集气瓶大于1/5后就不再进入,也说明氮气难溶于水
(3) 若将红磷换成碳粉,该实验不能获得成功,故填否,原因是:碳粉燃烧产物是二氧化碳气体,使得瓶内的压强变化不大
(4) 红磷熄灭后,打开止水夹后,发现最终进入集气瓶的水的体积小于1/5,可能的原因:1、红磷的用量不足,这样就不能充分消耗完瓶内的氧气,使测量结果偏小;2、装置的密封性不好,使得空气又会进入到集气瓶中,使得测量结果偏小;3、没有冷却到室温就打开止水夹,瓶内气体处于膨胀状态,体积变大,同样使得测量结果偏小;

【题目】(7分)用来测定空气成分的方法很多。如下图所示的是小芳同学用红磷在空气中燃烧的测定方法。实验过程是:
第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸 入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5。
请回答下列问题:
(1)上面的实验同时证明了氮气有___________的化学性质。 (答一点即可)
(2)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是________________________:_________________________。 (答两点即可)
【问题提出】有实验资料表明:此实验因为设计缺陷,在操作规范的情况下也常常测出氧气的含量会大于1/5
(3)小包同学设想用其他物质代替红磷进行实验(装置不变),则下列因素不会影响实验结果的是(填字母标号):_________
A.替代物能否和氧气反应 B.替代物的用量
C.替代物能否溶于水 D.生成物的状态
【实验改进】
Ⅰ. 根据铁在空气中生锈的原理设计图实验装置,再次测定空气中氧气含量。装置中饱和食盐水、活性炭会加速铁生锈。

Ⅱ.测定实验数据如表4
测量 项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 |
【交流表达】
(4)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化铁[Fe(OH)2],写出该反应的化学方程式 。
(5)根据表4数据计算,改进实验后测得的空气中氧气的体积分数是 (计算结果精确到0.1%)。
(6)从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:_________________________;(写一点)