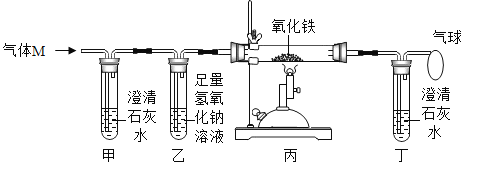
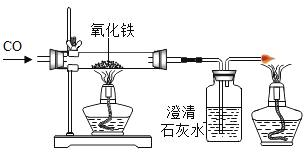
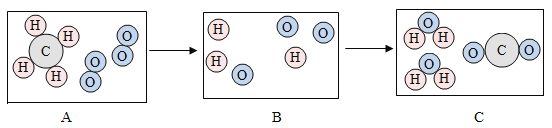
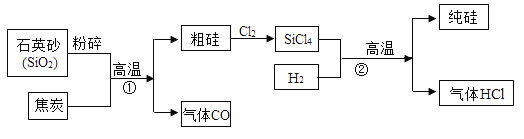
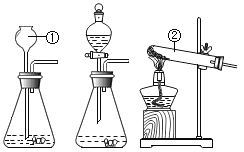
题目内容
【题目】下图烧杯中装有100g硫酸和硫酸镁的混合溶液,向该溶液中加入10%的氢氧化钠溶液至恰好反应完全时,生成沉淀5. 8g。请回答:
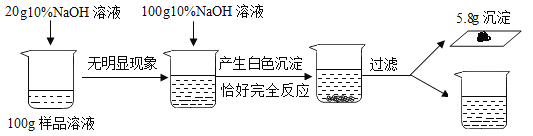
(1)若配制实验所用的氢氧化钠溶液,则需要24%的氢氧化钠溶液的质量为_____。
(2)写出第一次实验时反应的化学方程式_____。
(3)列出求解原混合溶液中含有硫酸镁质量(x)的比例式_____。
(4)第一次加完NaOH溶液后,溶液中溶质的成分为:_____。
(5)向过滤后所得溶液中蒸发72. 2g水后,所得溶液中溶质的质量分数为_____。
【答案】50g 2NaOH+H2SO4=Na2SO4+2H2O ![]() 硫酸、硫酸镁、硫酸钠 15%
硫酸、硫酸镁、硫酸钠 15%
【解析】
(1)若配制实验所用的氢氧化钠溶液,则需要24%的氢氧化钠溶液的质量=![]() ;
;
(2)向100g硫酸和硫酸镁的混合溶液加入氢氧化钠溶液,氢氧化钠先与硫酸反应生成硫酸钠和水,等硫酸完全反应后,氢氧化钠与硫酸镁反应生成氢氧化镁和硫酸钠,第一次实验时,没有明显现象,发生的反应是氢氧化钠与硫酸反应生成硫酸钠和水,化学方程式为:2NaOH+H2SO4==Na2SO4+2H2O;
(3)设原混合溶液中含有硫酸镁质量为x,生成5.8g氢氧化镁需要氢氧化钠溶液的质量为y;同时生成硫酸钠的质量为z。
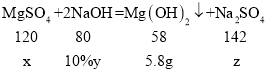
![]() x=12g;
x=12g;
![]() y=80g;
y=80g;
![]() z=14.2g;
z=14.2g;
(4)根据(3)计算可知,将硫酸完全消耗需要氢氧化钠溶液的质量=120g-80g=40g,第一次加完NaOH溶液后,仅消耗了部分硫酸,溶液中溶质的成分为:硫酸、硫酸镁、硫酸钠;
(5)设与硫酸反应生成的硫酸钠的质量为m。
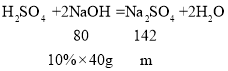
![]() m=7.1g ;
m=7.1g ;
向过滤后所得溶液中蒸发72. 2g水后,所得溶液中溶质的质量分数=![]() 。
。

【题目】通常条件下水的沸点是100℃。压强增大,沸点升高;压强减小,沸点降低。如图是研究水沸点随气压变化的实验。关闭止水夹,连接好装置,再将液体 A滴入试管②中,打开夹子,试管①内的水立刻沸腾。则液体A和物质B的组合可能是
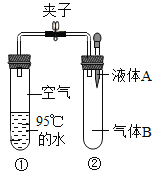
序 号 | A | B | C | D |
液体A | 双氧水 | 水 | 石灰水 | 稀盐酸 |
物质B | 二氧化锰 | 氧气 | 二氧化碳 | 大理石 |
A. AB. BC. CD. D