题目内容
【题目】化学是一门以实验为基础的学科。根据下图回答问题:
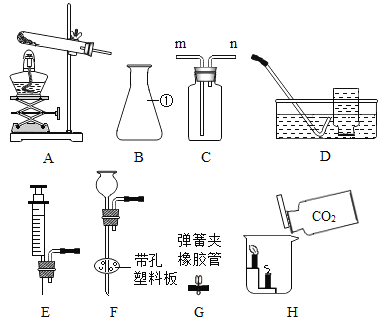
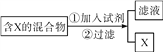
(1)仪器①的名称是_____。
(2)实验室用氯酸钾和二氧化锰制取氧气,反应的化学方程式为__,选用的发生装置是_____(填字母序号,下同)。
(3)实验室制取二氧化碳,发生装置要能达到“随开随起,随关随停”,需要选用的仪器和用品有____;反应的化学方程式为______;选用的收集装置是C,则二氧化碳从_____(填导管的序号)进入。检验收集到的气体是二氧化碳方法是_____其中发生的反应方程式为_____
(4)我们发现H装置中蜡烛由低到高依次熄灭,说明二氧化碳具有的性质是____
(5)小明同学以废弃的“棒棒冰”塑料管为材料,制成的气体发生装置(各部分连接紧密后,如图所示)。
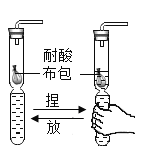
该实验设计的优点有:能控制反应速率和_____。(写一点即可)
【答案】锥形瓶 2KClO3![]() 2KCl+ 3O2↑ A BF CaCO3+2HCl=CaCl2+H2O+CO2↑ m 将生成气体通入澄清石灰水,澄清石灰水变浑浊,证明该气体是二氧化碳 CO2+Ca(OH)2=CaCO3↓+H2O CO2密度比空气大,不支持燃烧,也不能燃烧 节约药品或废物利用或降低成本或操作方便(合理均可)
2KCl+ 3O2↑ A BF CaCO3+2HCl=CaCl2+H2O+CO2↑ m 将生成气体通入澄清石灰水,澄清石灰水变浑浊,证明该气体是二氧化碳 CO2+Ca(OH)2=CaCO3↓+H2O CO2密度比空气大,不支持燃烧,也不能燃烧 节约药品或废物利用或降低成本或操作方便(合理均可)
【解析】
(1)通过分析题中所指仪器的作用可知,①是锥形瓶;
(2)氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,化学方程式为:2KClO3![]() 2KCl+3O2↑,该反应的反应物是固体,反应条件是加热,所以选用的发生装置是A;
2KCl+3O2↑,该反应的反应物是固体,反应条件是加热,所以选用的发生装置是A;
(3)发生装置要能达到“随开随起,随关随停”,需要选用的仪器和用品有BF,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,二氧化碳的密度比空气大,所以选用的收集装置是C,则二氧化碳从m进入,实验室用澄清石灰水检验二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以检验收集到的气体是二氧化碳方法是将生成的气体通入澄清石灰水中,澄清石灰水变浑浊,证明是二氧化碳,其中发生的反应方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(4)蜡烛由低到高依次熄灭的现象,所以说明二氧化碳具有的性质是二氧化碳密度比空气大,不支持燃烧,也不能燃烧;
(5)以废弃的“棒棒冰”塑料管为材料,制成的气体发生装置,实验设计的优点有:节约药品或废物利用或降低成本或操作方便。

【题目】请按下列要求填写。
(1)我能写出化学仪器名称及主要用途。
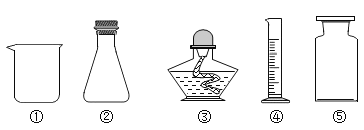
写出①②③的名称:①_____;②_____;③_____。
写出④⑤主要用途:④_____;⑤_____。
(2)我能写出基本实验的操作要点。

操作要点:_____;_____;_____。
(3)我熟悉实验的安全知识,我能处理实验事故。(将事故与处理方法用线连起来)。_____
酒精失火 | 在烫伤处涂上烫伤膏或万花油 |
割伤 | 请立即到室外呼吸新鲜空气,并请医生处理 |
烫伤 | 请立即用湿布覆盖 |
吸入有毒气体 | 请用3%双氧水清洗,涂上红药水或贴上止血贴 |
(4)我能说出实验观察到的实验现象,并能指出是物理变化还是化学变化。
①加热熔化石蜡
观察到的现象是:石蜡形状和状态_____(填“变化”或“不变化”),_____(填“有”或“没有”)生成新物质。结论:该变化属于_____变化。
②点燃镁条
观察到的现象是:银白色固体镁条燃烧时,发出_____光,释放出大量的_____,并生成_____状的物质。结论:该变化属于_____变化。
【题目】下图所示装置可用于实验室制取某些气体,并能随时控制反应发生与停止。下表中所选用的药品及制取的气体完全正确的一组是
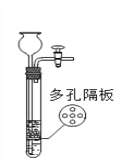
选项 | 选用的药品 | 制取的气体 | |
固体 | 液体 | ||
A | 块状大理石 | 稀硫酸 | 二氧化碳 |
B | 二氧化锰粉末 | 过氧化氢溶液 | 氧气 |
C | 块状大理石 | 稀盐酸 | 二氧化碳 |
D | 碳酸钠粉末 | 稀盐酸 | 二氧化碳 |
A. A B. B C. C D. D