题目内容
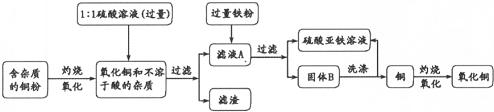
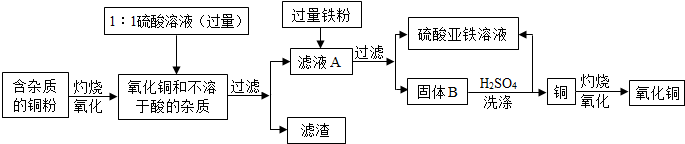
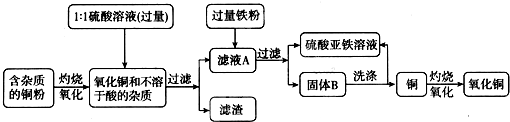
高纯度的氧化铜可用作颜料、有机合成催化剂等,以下是用粗铜氧化法获取高纯度氧化铜的流程图.
回答下列问题:
(1)1:1的硫酸溶液是用1体积98%的浓硫酸与1体积水混合而成,配制该硫酸溶液时,一定要把浓硫酸慢慢注入水中,并用
(2)写出硫酸与氧化铜反应的化学方程式
(3)写出固体B所含的物质:
(4)洗涤固体B所发生反应的化学方程式

回答下列问题:
(1)1:1的硫酸溶液是用1体积98%的浓硫酸与1体积水混合而成,配制该硫酸溶液时,一定要把浓硫酸慢慢注入水中,并用
玻璃棒
玻璃棒
不断搅拌;(2)写出硫酸与氧化铜反应的化学方程式
H2SO4+CuO=CuSO4+H2O
H2SO4+CuO=CuSO4+H2O
;(3)写出固体B所含的物质:
Fe和Cu
Fe和Cu
;(4)洗涤固体B所发生反应的化学方程式
Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
.分析:(1)浓硫酸溶于水会放出大量的热,稀释时一定要把浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌;
(2)氧化铜和硫酸反应生成硫酸铜和水;
(3)由于向滤液A中加入的是过量铁粉,故固体B中有铁和铜;
(4)除去铜中的铁粉,并生成硫酸亚铁,故应选择稀硫酸.
(2)氧化铜和硫酸反应生成硫酸铜和水;
(3)由于向滤液A中加入的是过量铁粉,故固体B中有铁和铜;
(4)除去铜中的铁粉,并生成硫酸亚铁,故应选择稀硫酸.
解答:解:(1)浓硫酸溶于水会放出大量的热,配制稀硫酸溶液时,一定要把浓硫酸慢慢注入水中,并不断搅拌.
(2)硫酸与氧化铜反应的反应物是硫酸和氧化铜,生成物是硫酸铜和水,所以化学方程式:H2SO4+CuO═CuSO4+H2O.
(3)滤液A的主要成分是硫酸铜溶液,向里面加入过量的铁粉,反应后的固体就是铁和铜的混合物;
(4)洗涤固体B的目的是除去铜粉中的铁粉,并生成硫酸亚铁,故应使用的试剂是稀硫酸,反应物是铁和硫酸,生成物是硫酸亚铁和氢气,所以方程式是:
Fe+H2SO4=FeSO4+H2↑.
故答案为:(1)玻璃棒;(2)①H2SO4+CuO=CuSO4+H2O;(3)Fe和Cu(或“铁和铜”);(4)Fe+H2SO4=FeSO4+H2↑.
(2)硫酸与氧化铜反应的反应物是硫酸和氧化铜,生成物是硫酸铜和水,所以化学方程式:H2SO4+CuO═CuSO4+H2O.
(3)滤液A的主要成分是硫酸铜溶液,向里面加入过量的铁粉,反应后的固体就是铁和铜的混合物;
(4)洗涤固体B的目的是除去铜粉中的铁粉,并生成硫酸亚铁,故应使用的试剂是稀硫酸,反应物是铁和硫酸,生成物是硫酸亚铁和氢气,所以方程式是:
Fe+H2SO4=FeSO4+H2↑.
故答案为:(1)玻璃棒;(2)①H2SO4+CuO=CuSO4+H2O;(3)Fe和Cu(或“铁和铜”);(4)Fe+H2SO4=FeSO4+H2↑.
点评:本题属于物质的提纯,要根据物质的性质选择适当的试剂和方法;洗涤金属时,要根据需除去的物质选择使用酸还是使用水.

练习册系列答案
相关题目