题目内容
(2013?江门模拟)高纯度的氧化铜可用作颜料、有机合成催化剂等,以下是用粗铜粉氧化法获取高纯度氧化铜的流程图.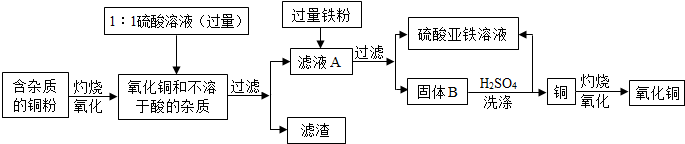
回答下列问题:
(1)1:1的硫酸溶液是用1体积98%的浓硫酸与1体积水混合而成,配制该硫酸溶液时,一定要把
(2)写出硫酸与氧化铜反应的化学方程式:
(3)流程图中过滤这一操作所用到的玻璃仪器除了烧杯、玻璃棒还有
(4)固体B洗涤的过程是化学变化,请写出该步发生反应的化学方程式:

回答下列问题:
(1)1:1的硫酸溶液是用1体积98%的浓硫酸与1体积水混合而成,配制该硫酸溶液时,一定要把
浓硫酸
浓硫酸
慢慢注入水
水
,并不断搅拌.(2)写出硫酸与氧化铜反应的化学方程式:
CuO+H2SO4=CuSO4+H2O
CuO+H2SO4=CuSO4+H2O
.(3)流程图中过滤这一操作所用到的玻璃仪器除了烧杯、玻璃棒还有
漏斗
漏斗
,其中玻璃棒的作用是引流,防止液滴飞溅
引流,防止液滴飞溅
.(4)固体B洗涤的过程是化学变化,请写出该步发生反应的化学方程式:
Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
.分析:粗铜氧化法获取高纯度氧化铜的过程是先通过灼烧,把铜变为氧化铜,再加入硫酸,用硫酸与氧化铜反应生成硫酸铜,不与酸反应的杂质通过过滤除掉,再向硫酸铜溶液中加入过量的铁粉,为的是将硫酸铜中的铜全部置换出来,再将铜中混有的过量的铁用硫酸除掉,为了将铁粉除净,可用硫酸去清洗铜粉,据此分析解答即可.
解答:解:(1)1:1的硫酸溶液是用1体积98%的浓硫酸与1体积水混合而成,配制该硫酸溶液时,一定要把 浓硫酸 慢慢注入 水,并不断搅拌.切不可将水倒入浓硫酸里.
(2)硫酸与氧化铜反应生成硫酸铜和水,化学方程式为 CuO+H2SO4=CuSO4+H2O.
(3)过滤操作所用到的玻璃仪器除了烧杯、玻璃棒还有 漏斗,其中玻璃棒的作用是 引流,防止液滴飞溅.
(4)粗铜氧化法获取高纯度氧化铜的过程是先通过灼烧,把铜变为氧化铜,再加入硫酸,用硫酸与氧化铜反应生成硫酸铜,不与酸反应的杂质通过过滤除掉,再向硫酸铜溶液中加入过量的铁粉,为的是将硫酸铜中的铜全部置换出来,再将铜中混有的过量的铁用硫酸除掉,为了将铁粉除净,可用硫酸去清洗铜粉,固体B洗涤的过程即为铁与硫酸反应的过程,发生反应的化学方程式:Fe+H2SO4=FeSO4+H2↑
故答案为(1)浓硫酸 水 (2)CuO+H2SO4=CuSO4+H2O
(3)漏斗 引流,防止液滴飞溅
(4)Fe+H2SO4=FeSO4+H2↑
(2)硫酸与氧化铜反应生成硫酸铜和水,化学方程式为 CuO+H2SO4=CuSO4+H2O.
(3)过滤操作所用到的玻璃仪器除了烧杯、玻璃棒还有 漏斗,其中玻璃棒的作用是 引流,防止液滴飞溅.
(4)粗铜氧化法获取高纯度氧化铜的过程是先通过灼烧,把铜变为氧化铜,再加入硫酸,用硫酸与氧化铜反应生成硫酸铜,不与酸反应的杂质通过过滤除掉,再向硫酸铜溶液中加入过量的铁粉,为的是将硫酸铜中的铜全部置换出来,再将铜中混有的过量的铁用硫酸除掉,为了将铁粉除净,可用硫酸去清洗铜粉,固体B洗涤的过程即为铁与硫酸反应的过程,发生反应的化学方程式:Fe+H2SO4=FeSO4+H2↑
故答案为(1)浓硫酸 水 (2)CuO+H2SO4=CuSO4+H2O
(3)漏斗 引流,防止液滴飞溅
(4)Fe+H2SO4=FeSO4+H2↑
点评:本题以粗铜粉氧化法生产高纯度CuO的流程图来考查学生物质的转化及基本的实验操作,明确每步转化后物质的成分及转化中的反应是解答的关键.

练习册系列答案
相关题目