题目内容
【题目】盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。
(1)打开浓盐酸的试剂瓶,观察到瓶口有______,这是因为浓盐酸有______性。
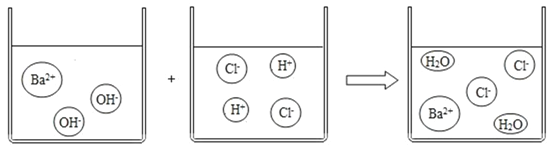
(2)根据如图写出反应的化学方程式______。
【答案】白雾 挥发 Ba(OH)2+2HCl=BaCl2+2H2O
【解析】
(1)打开浓盐酸的试剂瓶,观察到瓶口有白雾产生,这是因为浓盐酸有挥发性,从浓盐酸中挥发出来的氯化氢气体与水蒸气接触,形成了盐酸小液滴。
(2)由图中微观示意图,是氢氧化钡与稀盐酸反应生成氯化钡和水,反应的实质是氢离子结合氢氧根离子生成了水分子,反应的化学方程式为:Ba(OH)2+2HCl═BaCl2+2H2O。
故答案为:(1)白雾;挥发;(2)Ba(OH)2+2HCl═BaCl2+2H2O。

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
【题目】某校兴趣小组探究学校附近赤铁矿中Fe2O3的纯度.他们采集了80g矿样,粉碎后均分成四等份,分别置于四个烧杯中,然后分别向四个烧杯中加入同一浓度的稀硫酸,加入硫酸的质量与反应后剩余固体质量如下表所示.(假设矿石中的杂质既不和稀硫酸反应,也不溶于水)
实验1 | 实验2 | 实验3 | 实验4 | |
加稀硫酸质量 | 150g | 240g | 330g | 400g |
剩余固体质量 | 12g | 7.2g | 4g | 4g |
求:①该矿样中Fe2O3的质量分数_______.
②所用稀硫酸的溶质质量分数_______.