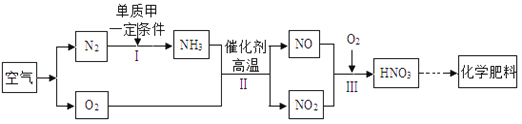
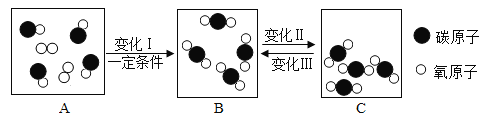
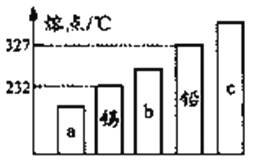
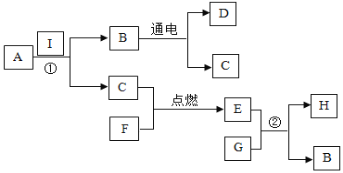
题目内容
【题目】某纯净物3 g在氧气中完全燃烧,生成8.8 g二氧化碳和5.4 g水。下列说法不正确的是( )
A. 该反应中O2和CO2的质量比为14∶11 B. 该纯净物中含有C、H元素,不含O元素
C. 该纯净物中C、H原子的个数比为1∶4 D. 该反应中O2和H2O的分子数之比为7∶6
【答案】C
【解析】
根据质量守恒定律的含义(即六不变)中的“元素的种类不变”可知,生成物所含的碳、氢、氧三种元素中的碳元素和氢元素一定来自于纯净物,至于氧元素可能全部来自于氧气,也可能部分来自于氧气,另一部分则来自于3g物质,可根据元素的质量不变进行判断;根据生成物CO2和H2O中C、H元素质量,让碳氢元素的质量分别除以各自的相对原子质量再相比,就可以得到该物质中碳氢两元素的原子个数比。
A、根据质量守恒定律可知,参加反应的氧气的质量为8.8g+5.4g-3g=11.2g,则该反应中O2和CO2的质量比为11.2g:8.8g=14:11,故说法正确;
B、根据质量守恒定律可知,化学反应前后元素的种类保持不变;说明该物质一定含有氢元素和碳元素,可能含有氧元素;又因为:二氧化碳中碳元素的质量等于8.8g×![]() =2.4g,水中氢元素的质量等于5.4g×
=2.4g,水中氢元素的质量等于5.4g×![]() =0.6g,因此氢元素和碳元素的质量之和是2.4g+0.6g═3.0g,说明该物质仅含有碳元素和氢元素,故说法正确;
=0.6g,因此氢元素和碳元素的质量之和是2.4g+0.6g═3.0g,说明该物质仅含有碳元素和氢元素,故说法正确;
C、该纯净物中C、H原子的个数比为![]() :
:![]() =1:3,故说法错误;
=1:3,故说法错误;
D、反应中O2和H2O的分子数之比为![]() :
:![]() =7:6,故说法正确。
=7:6,故说法正确。
故选C。

【题目】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图1),
写出红磷燃烧的化学方程式____。打开止水夹后,水能进入集气瓶中的原因是______。
(提出问题)某兴趣小组用该方法测出的氧气含量常常远低于21%。为什么?
(进行猜想)(1)装置漏气;(2)________(3)反应后未冷却到室温……
在老师的指导下,小组同学在装置气密性能良好、操作规范的情况下,重复图1实验,测定结果低于20%,用测氧气浓度的传感器测得反应后装置内氧气浓度为8.85%.
(查阅资料):燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测量结果与理论值误差较大。
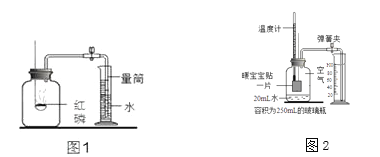
(实验探究)再次测定空气中氧气含量。
该小组同学根据铁在空气中生锈的原理设计图2实验装置。
Ⅰ.同学们采用了“暖宝宝”做实验,暖宝宝中含有铁粉、活性炭、水、氯化钠等物质。装置中饱和食盐水会加速铁生锈。
铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁。
工业上用一氧化碳还原赤铁矿(主要成分氧化铁),写出该反应的化学方程式: ______。
Ⅱ.8分钟后测得的实验数据如下表。根据如表数据计算,改进实验后测得的空气中氧气的体积分数是 ________。(写出数据表达式即可)
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物) 和导管的容积 | |
体积/mL | 100.0 | 74.5 | 126.0 |
(结论)该测定方法,装置内残留的氧气更少,实验结果更准确。
(拓展)小组中某同学认为实验后的暖宝宝贴中仍含有铁粉,才能说明该结果接近精确值。
请你设计实验证明反应后的暖宝宝中仍有铁单质存在__________。