题目内容
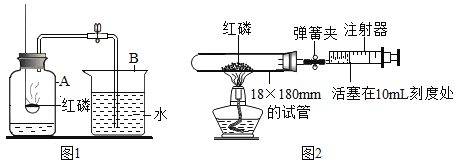
【题目】实验室常用下列装置来制取和收集氧气:
(1)写出图中有标号仪器的名称:a________ b________。
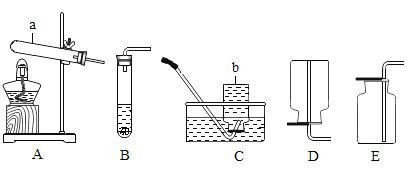
(2)用过氧化氢溶液制取氧气时,①可选用的发生装置是________(填字母序号);
②不能用D装置收集该气体的原因是____________;
③气体发生装置加人药品之前,必须进行的操作是____________;
④该化学反应的基本反应类型是_________,化学方程式是_________。
【答案】试管 集气瓶 B 它的密度比空气大 检查装置的气密性 分解反应 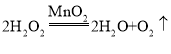
【解析】
(1)a是试管,b是集气瓶;
(2)
①用过氧化氢溶液制取氧气无需加热,选B作为发生装置;
②氧气的密度比空气大,要用向上排空气法收集气体,不能选D装置;
③实验室制取气体时,组装好装置后,应在向容器中装入药品前检查装置的气密性,然后再装入药品;
④过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为: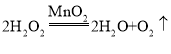 ,一变多,属于分解反应。
,一变多,属于分解反应。
故答案为:
(1)试管,集气瓶;
(2)
①B;
②它的密度比空气大;
③检查装置的气密性;
④分解反应,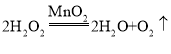 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】同学们在研究氧气性质时,进行了如图1的实验;取一段打磨好的螺旋状铁丝,在下端系一根火柴,点燃火柴,待火柴快燃尽时,插入充满氧气且放有少量水的集气瓶中,观察到如下现象:
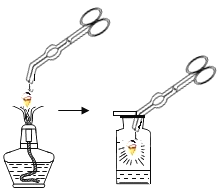
银白色的铁丝在氧气中剧烈燃烧,________,放出大量的热,生成黑色固体物质。该实验说明铁丝能够在氧气中燃烧,氧气具有助燃性。
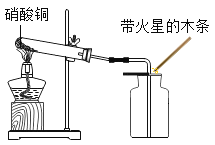
小明在阅读相关资料时发现二氧化氮也具有助燃性,他决定利用如下实验进行探究。
(提出问题)二氧化氮是否具有助燃性?
(查阅资料)
①蓝色的硝酸铜固体在加热条件下分解生成氧化铜、二氧化氮和氧气。
②氧化铜是一种黑色固体,通常状况下,二氧化氮是一种红棕色气体,相同状况下,其密度大于氧气密度,在低于室温时变成液态。
(实验过程)
实验装置 | 实验现象 | 实验结论 |
| 试管内蓝色固体逐渐变为黑色,有红棕色气体生成,________。 | 二氧化氮具有助燃性。 |
(反思与评价)
小刚认为小明的实验不能证明![]() 具有助燃性,其理由是________.
具有助燃性,其理由是________.
小刚认为利用补充如下实验可以证明![]() 具有助燃性.
具有助燃性.
实验操作 | 实验现象 | 实验结论 |
步骤I:在上图的试管和集气瓶之间连上如图所示的装置,重新进行加热硝酸铜的实验
| 带火星的木条复燃。 | 硝酸铜分解产物中有________。 |
步骤II:取出图中的U型管,恢复至室温,待U型管内充满红棕色气体时,将带火星的木条伸入U型管中。 | 带火星的木条复燃。 |
|
小红认为即使不进行小刚的实验,依据资料和小明的实验现象也能推出![]() 具有助燃性,其理由是________。
具有助燃性,其理由是________。
【题目】空气是宝贵的自然资源。利用氢气(H2)和空气中分离出的氮气(N2)可以合成氨气(NH3),下列是合成氨的工艺流程图:

(1)工业上用分离液态空气的方法获得氮气。将空气液化后再气化,首先分离出氮气,剩下的主要是液氧。
根据下表中各物质的沸点,如要将产物 NH3与 N2、H2分离开来,温度应该控制在______℃的范围之内。
物质 | H2 | N2 | NH3 |
沸点/℃ | -252 | -195.8 | -33.4 |
(2)用“〇”表示氢原子,“![]() ”表示氮原子,“
”表示氮原子,“![]() ”表示催化剂,观察下列微观图,合成氨化学反应过程的微观顺序为________(将下面三张图用序号排列)。
”表示催化剂,观察下列微观图,合成氨化学反应过程的微观顺序为________(将下面三张图用序号排列)。
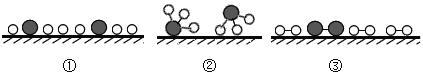
(3)用焦炭(主要成分是碳)和水蒸气在高温条件下反应可制得氢气和另一种常温下为气态的有毒物质,写出该反应的文字表达式_____________。在煤和水蒸气反应前需先将煤粉碎,这样做的目的是_____________。
(4)实际生产中,N2和H2不可能全部转化为NH3。将降温分离出的N2、H2送回合成塔的目的是______。
A充分利用原料 B防止氮气污染空气