题目内容
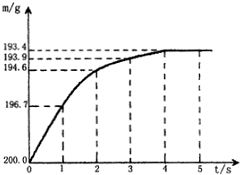
向盛有20.0g含杂质的碳酸氢钠固体(NaHCO3)的烧杯中,加入100.5g硫酸溶液恰好反应(杂质不反应).反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示.烧杯连同药品的起始质量为200.0g.反应的化学方程式为:
2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑
回答下列问题:
(1)当碳酸氢钠与硫酸溶液恰好完全反应时,所需的时间约为______.
(2)当碳酸氢钠与硫酸溶液完全反应时,所产生二氧化碳的质量为______.
(3)计算含杂质的碳酸氢钠固体中碳酸氢钠的纯度.
2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑
回答下列问题:
(1)当碳酸氢钠与硫酸溶液恰好完全反应时,所需的时间约为______.
(2)当碳酸氢钠与硫酸溶液完全反应时,所产生二氧化碳的质量为______.
(3)计算含杂质的碳酸氢钠固体中碳酸氢钠的纯度.

(1)根据题给图示,碳酸氢钠与硫酸溶液恰好完全反应时,所需的时间是4s,因为此时以后烧杯连同药品的质量不再变化;故填:4s;
(2)根据题意及题给图示,烧杯连同药品的起始质量为200.0g,碳酸氢钠与硫酸溶液恰好完全反应后烧杯连同药品的质量为193.4g,由质量守恒定律求得生成二氧化碳的质量为:200.0g-193.4g=6.6g;故填:6.6g;
(3)设碳酸氢钠的质量为x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
168 88
x 6.6g
=
x=12.6g
含杂质的碳酸氢钠固体中碳酸氢钠的纯度=
×100%=63%
答:含杂质的碳酸氢钠固体中碳酸氢钠的纯度为63%.
(2)根据题意及题给图示,烧杯连同药品的起始质量为200.0g,碳酸氢钠与硫酸溶液恰好完全反应后烧杯连同药品的质量为193.4g,由质量守恒定律求得生成二氧化碳的质量为:200.0g-193.4g=6.6g;故填:6.6g;
(3)设碳酸氢钠的质量为x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
168 88
x 6.6g
| 168 |
| x |
| 88 |
| 6.6g |
x=12.6g
含杂质的碳酸氢钠固体中碳酸氢钠的纯度=
| 12.6g |
| 20g |
答:含杂质的碳酸氢钠固体中碳酸氢钠的纯度为63%.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目